Perbezaan antara bromin dan klorin

- 1525
- 149
- Ms. Alejandro Nikolaus
Kumpulan sistem berkala termasuk unsur fluorin (f), klorin (CL), bromin (BR), iodin (I) dan astatine (AT). Semua elemen ini dikenali di bawah nama generik "elemen halogen" dan mempunyai sifat kimia bukan logam.

Apa itu Bromine?
- Bromine (BR) adalah elemen kimia bukan logam kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah cecair coklat kemerahan dengan bau yang sangat menjengkelkan.
- Bromin nombor 35 dalam jadual berkala dan mempunyai jisim atom 79.904.
- Ia kurang reaktif daripada klorin. Walau bagaimanapun, dalam keadaan normal, bromin mengambil bahagian dalam pelbagai interaksi kimia.
- Penyelesaian berair bromin molekul (2.8%) dipanggil air bromin dan digunakan dalam banyak reaksi organik. Umumnya, bromin larut dalam pelarut organik. Selalunya, dalam sebatian, ia mempamerkan keadaan pengoksidaan -1, tetapi juga boleh berada dalam keadaan pengoksidaan positif yang ganjil (+1, +3, +5, +7).
- Secara semula jadi, bromin berlaku dalam bentuk campuran dua isotop stabil. Ia terkandung sebagai kekotoran dalam mineral klorin Halite (NaCl - Salt), Sylvite (KCl), Carnallite (Potassium Magnesium Hexahydrate), dll. Kandungannya dalam air laut adalah kira -kira 1: 660 atom klorin.
- Penggunaan bromin termasuk persediaan farmaseutikal, racun perosak, pewarna, retardan api, dll. Pada masa lalu, kalium bromida telah digunakan sebagai sedatif dan anticonvulsant.

Apa itu klorin?
- Klorin (CL) adalah elemen kimia bukan logam kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
- Klorin adalah nombor 17 dalam jadual berkala dan mempunyai jisim atom 35.453.
- Klorin adalah elemen kimia yang sangat aktif. Dalam interaksi kimia, ia biasanya kelihatan sebagai oksidan yang kuat dan dalam sebatian kimianya paling kerap -1 keadaan pengoksidaan. Apabila terdapat oksidan yang lebih kuat dalam molekul, atom klorin mempunyai keadaan pengoksidaan positif. Sebagai contoh, dalam asid perchloric, keadaan pengoksidaan atom klorin mencapai +7. Klorin boleh hadir di semua keadaan pengoksidaan dari -1 hingga +7, kecuali +2.
- Secara semula jadi, sumber klorin sebagai bahan mudah tidak diketahui setakat ini dan ia hanya berlaku dalam bentuk sebatian kimia atau dipisahkan dalam bentuk ion. Galian yang merupakan sumber klorin adalah halite (NaCl - Salt), Sylvite (KCl), Carnallite (Potassium Magnesium Hexahydrate), dan lain -lain. Laut dan lautan mengandungi anion klorin kerana garam terlarut. Oleh kerana kehidupan di bumi berasal dari perairan asin yang sama, cecair dalaman organisma kita juga mengandungi banyak ion klorin.
- Klorin adalah bahan mentah yang penting dalam pengeluaran asid hidroklorik. Penggunaannya dalam isi rumah cukup penting kerana ia adalah ramuan produk pembersihan bakterisida yang paling biasa. Persiapan yang mengandungi klorin memusnahkan semua bakteria yang diketahui. Dalam bentuk radikal, atom klorin sangat reaktif, yang menjadikan mereka karsinogen yang kuat.
Perbezaan antara bromin dan klorin
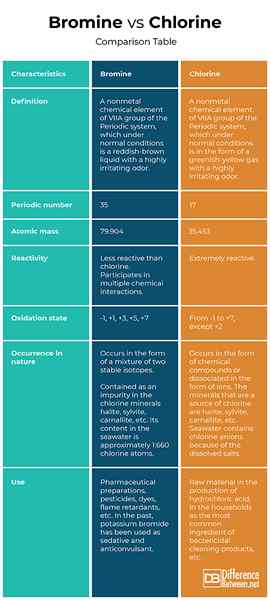
Definisi
Bromin: Bromin adalah elemen kimia nonmetal kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah cecair coklat kemerahan dengan bau yang sangat menjengkelkan.
Klorin: Klorin adalah elemen kimia bukan logam kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
Nombor berkala
Bromin: Bromin nombor 35 dalam jadual berkala.
Klorin: Klorin nombor 17 dalam jadual berkala.
Jisim atom
Bromin: Jisim atom bromin adalah 79.904.
Klorin: Jisim atom klorin adalah 35.453.
Reaktiviti
Bromin: Bromin kurang reaktif daripada klorin. Walau bagaimanapun, dalam keadaan normal, bromin mengambil bahagian dalam pelbagai interaksi kimia.
Klorin: Klorin adalah elemen kimia yang sangat aktif.
Keadaan pengoksidaan
Bromin: Selalunya dalam sebatian kimia bromin mempamerkan keadaan pengoksidaan -1, tetapi juga boleh berada dalam keadaan pengoksidaan positif yang ganjil (+1, +3, +5, +7).
Klorin: Klorin boleh hadir di semua keadaan pengoksidaan dari -1 hingga +7, kecuali +2. Ia adalah oksidan yang kuat dan dalam sebatian kimianya paling kerap adalah -1 keadaan pengoksidaan.
Kejadian dalam alam
Bromin: Secara semula jadi, bromin berlaku dalam bentuk campuran dua isotop stabil. Ia terkandung sebagai kekotoran dalam mineral klorin Halite (NaCl - Salt), Sylvite (KCl), Carnallite (Potassium Magnesium Hexahydrate), dll. Kandungannya dalam air laut adalah kira -kira 1: 660 atom klorin.
Klorin: Dalam sifat klorin hanya berlaku dalam bentuk sebatian kimia atau dipisahkan dalam bentuk ion. Galian yang merupakan sumber klorin adalah halite (NaCl - Salt), Sylvite (KCl), Carnallite (Potassium Magnesium Hexahydrate), dan lain -lain. Air laut mengandungi anion klorin kerana garam terlarut.
Gunakan
Bromin: Penggunaan bromin termasuk persediaan farmaseutikal, racun perosak, pewarna, retardan api, sanitasi kolam, dll. Pada masa lalu, kalium bromida telah digunakan sebagai sedatif dan anticonvulsant.
Klorin: Klorin digunakan sebagai bahan mentah dalam pengeluaran asid hidroklorik, dalam isi rumah sebagai bahan pembersihan bakterisida yang paling biasa, untuk membersihkan kolam, dll.
Bromine vs. Klorin: Jadual Perbandingan
Ringkasan Bromine vs. Klorin
- Bromin adalah elemen kimia nonmetal kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah cecair coklat kemerahan dengan bau yang sangat menjengkelkan.
- Klorin adalah elemen kimia bukan logam kumpulan VIIA sistem berkala, yang dalam keadaan normal adalah dalam bentuk gas kuning kehijauan dengan bau yang sangat menjengkelkan.
- Bromin nombor 35 dalam jadual berkala dan klorin nombor 17.
- Jisim atom bromin adalah 79.904, jisim atom klorin adalah 35.453.
- Bromin kurang reaktif daripada klorin. Walau bagaimanapun, dalam keadaan normal, bromin mengambil bahagian dalam pelbagai interaksi kimia.
- Selalunya dalam sebatian kimia bromin mempamerkan keadaan pengoksidaan -1, tetapi ia juga boleh berada dalam keadaan pengoksidaan positif yang ganjil (+1, +3, +5, +7). Klorin boleh hadir di semua keadaan pengoksidaan dari -1 hingga +7, kecuali +2.
- Secara semula jadi, bromin berlaku dalam bentuk campuran dua isotop stabil. Klorin hanya berlaku dalam bentuk sebatian kimia atau dipisahkan dalam bentuk ion.
- Penggunaan bromin termasuk persediaan farmaseutikal, racun perosak, pewarna, retardan api, sanitasi kolam, dll. Pada masa lalu, kalium bromida telah digunakan sebagai sedatif dan anticonvulsant. Klorin digunakan sebagai bahan mentah dalam pengeluaran asid hidroklorik, dalam isi rumah sebagai bahan pembersihan bakterisida yang paling biasa, untuk membersihkan kolam, dll.

