Perbezaan antara geometri elektron dan geometri molekul
- 4068
- 920
- Joe Schmidt Sr.
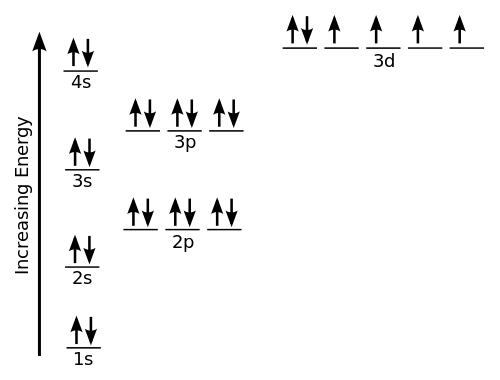
Kimia adalah kajian perkara dan ia berkaitan dengan banyak cara satu perkara boleh diubah menjadi jenis lain. Adalah diketahui bahawa semua perkara diperbuat daripada satu atau lebih dari kira -kira seratus jenis atom. Semua atom terdiri daripada tiga zarah asas - proton, elektron, dan neutron. Molekul terdiri daripada sekumpulan dua atau lebih atom yang dipegang bersama dalam corak geometri yang pasti. Apabila dua atau lebih atom dipegang bersama -sama untuk membentuk molekul, terdapat ikatan kimia antara setiap atom dan jirannya yang dekat. Bentuk molekul menyampaikan banyak maklumat dan langkah pertama untuk memahami kimia molekul adalah untuk mengetahui geometrinya.
Geometri molekul hanya merujuk kepada susunan tiga dimensi atom yang membentuk molekul. Struktur istilah agak digunakan dalam erti kata untuk menunjukkan hanya sambungan atom. Bentuk molekul ditentukan dari segi jarak antara nukleus atom yang terikat bersama. Geometri molekul ditentukan oleh teori penolakan elektron valensi-shell (VESPR)- model yang digunakan untuk menentukan bentuk umum molekul berdasarkan bilangan pasangan elektron di sekitar atom pusat. Geometri molekul diberikan sama ada sebagai geometri elektron atau geometri molekul.

Apakah geometri elektron?
Istilah geometri elektron merujuk kepada nama geometri pasangan elektron/kumpulan/domain pada atom pusat, sama ada ia ikatan elektron atau elektron bukan ikatan. Pasangan elektron ditakrifkan sebagai elektron berpasangan atau ikatan, pasangan tunggal, atau kadang -kadang satu elektron yang tidak berpasangan. Kerana elektron sentiasa bergerak dan laluan mereka tidak dapat ditakrifkan dengan tepat, susunan elektron dalam molekul diterangkan dari segi pengagihan ketumpatan elektron. Mari kita ambil contoh metana, formula kimia yang mana adalah ch4. Di sini, atom pusat adalah karbon dengan 4 elektron valensi dan 4 elektron saham hidrogen dengan 1 karbon untuk membentuk 4 ikatan kovalen. Ini bermakna terdapat sejumlah 8 elektron di sekitar karbon dan tidak ada satu ikatan, jadi bilangan pasangan tunggal di sini adalah 0. Ia mencadangkan ch4 adalah geometri tetrahedral.
Apakah geometri molekul?
Geometri molekul digunakan untuk menentukan bentuk molekul. Ia hanya merujuk kepada susunan tiga dimensi atau struktur atom dalam molekul. Memahami geometri molekul sebatian membantu menentukan kereaktifan, polariti, warna, fasa bahan, dan magnet. Geometri molekul biasanya diterangkan dari segi panjang bon, sudut ikatan, dan sudut kilasan. Untuk molekul kecil, formula molekul dan jadual panjang ikatan dan sudut piawai mungkin semua yang diperlukan untuk menentukan geometri molekul. Tidak seperti geometri elektron, ia diramalkan dengan mempertimbangkan hanya pasangan elektron. Mari ambil contoh air (h2O). Di sini, oksigen (O) adalah atom pusat dengan 6 elektron valensi sehingga memerlukan 2 lagi elektron dari 2 atom hidrogen untuk menyelesaikan oktetnya. Oleh itu, terdapat 4 kumpulan elektron yang diatur dalam bentuk tetrahedral. Terdapat juga 2 pasangan ikatan tunggal, jadi bentuk yang dihasilkan dibengkokkan.
Perbezaan antara geometri elektron dan geometri molekul
Terminologi untuk geometri elektron dan geometri molekul
Istilah geometri elektron merujuk kepada nama geometri pasangan elektron/kumpulan/domain pada atom pusat, sama ada ia ikatan elektron atau elektron bukan ikatan. Ia membantu memahami bagaimana kumpulan elektron yang berbeza disusun dalam molekul. Geometri molekul, sebaliknya, menentukan bentuk molekul dan ia adalah struktur tiga dimensi atom dalam molekul. Ia membantu memahami keseluruhan atom dan susunannya.
Geometri
Geometri molekul ditentukan berdasarkan hanya pasangan elektron ikatan tetapi bukan bilangan pasangan elektron. Ia adalah bentuk tiga dimensi yang molekul menduduki ruang angkasa. Geometri molekul juga ditakrifkan sebagai kedudukan nukleus atom dalam molekul. Geometri elektron molekul, sebaliknya, ditentukan berdasarkan kedua -dua pasangan elektron ikatan dan pasangan elektron tunggal. Geometri elektron dapat ditentukan menggunakan teori VESPR.
Contoh geometri elektron dan geometri molekul
Salah satu contoh geometri elektron tetrahedral ialah ammonia (NH3). Atom tengah di sini adalah n dan empat pasangan elektron diedarkan dalam bentuk tetrahedron dengan hanya satu pasangan elektron. Oleh itu, geometri elektron NH3 adalah tetrahedral. Walau bagaimanapun, geometri molekulnya adalah piramida trigonal kerana sudut ikatan adalah 107 darjah kerana atom hidrogen ditolak oleh sepasang elektron tunggal di sekitar nitrogen. Begitu juga, geometri molekul air (h2O) dibengkokkan kerana terdapat 2 pasangan bon tunggal.
Geometri elektron vs. Geometri Molekul: Carta Perbandingan

Ringkasan Geometri Elektron vs. Geometri molekul
Kedua-dua geometri elektron dan geometri molekul mengikuti model penolakan elektron valensi-shell (VESPR) untuk menentukan bentuk umum molekul berdasarkan bilangan pasangan elektron di sekitar atom pusat. Walau bagaimanapun, geometri molekul ditentukan semata -mata berdasarkan pasangan elektron ikatan, bukan bilangan pasangan elektron, sedangkan geometri elektron ditentukan berdasarkan kedua -dua pasangan elektron ikatan dan pasangan elektron tunggal. Apabila tiada satu -satunya pasang elektron yang terdapat dalam molekul, geometri elektron sama dengan bentuk molekul. Seperti yang kita katakan, bentuk molekul mengatakan banyak mengenainya dan langkah pertama untuk memahami kimia molekul adalah untuk menentukan geometrinya.

