Perbezaan antara sel galvanik dan sel elektrolisis
- 4660
- 137
- Ms. Armando Hammes
Terdapat dua jenis sel elektrokimia: sel galvanik - dengan proses redoks spontan yang membolehkan aliran elektron berterusan melalui konduktor, di mana tenaga kimia berubah menjadi elektrik; dan elektrolitik, di mana tindak balas redoks dipengaruhi oleh sumber luaran arus, di mana elektrik ditukar dalam tenaga kimia.

Apa itu sel galvanik?
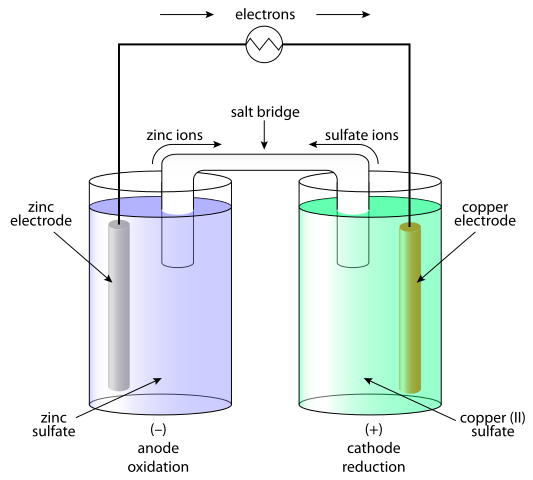
Sel galvanik adalah sistem di mana tenaga kimia berubah menjadi elektrik dan hasilnya arus dijana. Dalam sel-sel galvanik, arus langsung dihasilkan sebagai hasil proses redoks (pengurangan pengoksidaan). Unsur galvanik terdiri daripada dua sel separuh. Sel separuh terdiri daripada elektrolit dan elektrod yang direndam di dalamnya. Di antara sel separuh ini, hubungan mesti disediakan, menghubungkan elektrolit dengan jambatan garam atau membran separa konduktif dan menghubungkan elektrod dengan konduktor. Pemisahan proses redoks dijelaskan oleh tingkah laku elektrod berhubung dengan elektrolit. Pilihan yang paling mudah ialah sel separuh terbentuk daripada elektrod logam yang direndam dalam koresponden ion yang mengandungi elektrolit dengan elektrod. Tingkah laku logam dalam elektrolit bergantung kepada kereaktifan logam i.e. kecenderungannya untuk dibubarkan.
Apakah sel elektrolitik?
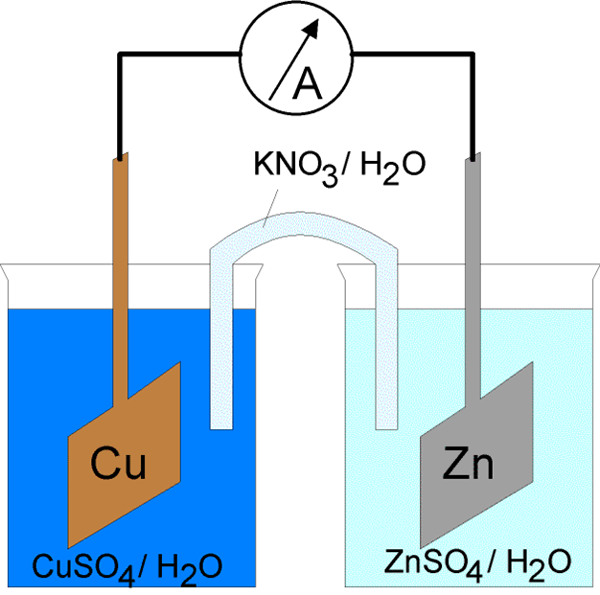
Arus elektrik melalui sel elektrokimia dapat dimulakan dalam dua cara. Yang pertama adalah menyambungkan elektrod dengan konduktor ke litar elektrik tertutup. Dengan menutup litar elektrik, mungkin secara spontan mendorong tindak balas elektrod pada kedua -dua fasa logam/elektrolit. Di samping itu, tenaga arus dikeluarkan dengan mengorbankan tenaga tindak balas kimia spontan. Sel yang berfungsi dengan cara ini dipanggil sel galvanik. Ini dijelaskan di atas. Cara lain ialah menutup litar elektrik dengan ikatan bersiri sumber luaran arus berbanding dengan voltan sel, di mana voltan luaran lebih besar daripada daya elektromotif sel. Ia memacu arus ke arah yang bertentangan dari arah aliran spontan melalui sel. Oleh sebab itu, reaksi elektrod dalam sel harus bertentangan dengan arah aliran spontan mereka. Proses terpaksa dalam sel elektrokimia di bawah pengaruh sumber luaran arus elektrik dipanggil elektrolisis, dan sel elektrokimia dalam cara operasi sedemikian dipanggil sel elektrolisis.
Perbezaan antara sel galvanik dan elektrolitik
-
Definisi sel galvanik dan elektrolitik
Dalam sel galvanik terdapat proses redoks spontan yang membolehkan aliran elektron berterusan melalui konduktor, di mana tenaga kimia ditukar menjadi elektrik. Dalam sel elektrolitik, tindak balas redoks berlaku di bawah pengaruh sumber luaran, di mana elektrik ditukar menjadi tenaga kimia. Reaksi redoks tidak bersebelahan.
-
Teknik sel galvanik dan elektrolitik
Sel galvanik menjana elektrik dengan bantuan tindak balas kimia. Dalam sel elektrolisis, arus elektrik digunakan untuk pembangunan tindak balas kimia, menggunakan sumber luaran di sepanjang jalan.
-
Reka bentuk sel galvanik dan elektrolisis
Sel Galvanik terdiri daripada dua elektrod yang berbeza yang direndam dalam penyelesaian ion mereka yang dipisahkan oleh membran semipermeable atau jambatan garam. Sel elektrolisis terdiri daripada bekas elektrolitik di mana dua elektrod disambungkan ke sumber DC. Elektrolit mungkin cair atau larutan berair dari garam, asid atau alkali.
-
Polariti elektrod dalam sel galvanik dan elektrolisis
Dalam sel galvanik anod adalah negatif dan katod adalah elektrod positif. Dalam sel elektrolitik, sebaliknya berlaku.
-
Reaksi kimia dalam sel galvanik dan elektrolisis
Sekiranya sel galvanik, tindak balas pengoksidaan berlaku di anod (elektrod negatif) di mana terdapat lebihan caj negatif. Di katod, tindak balas pengurangan berlaku, mendorong penumpukan positif. Sekiranya sel elektrolitik, sumber luar digunakan untuk mencetuskan tindak balas. Pada elektrod negatif, elektron ditolak - jadi fasa pengurangan akan berlaku pada elektrod negatif. Pada elektrod positif fasa pengoksidaan berlaku - dan ini adalah anod.
-
Penggunaan sel galvanik dan elektrolitik
Sel galvanik digunakan sebagai sumber arus elektrik, dan lebih sering dirujuk sebagai bateri atau akumulator. Sel -sel elektrolitik mempunyai kegunaan praktikal yang berbeza, sesetengah daripada mereka membuat gas hidrogen dan oksigen untuk aplikasi komersial dan perindustrian, elektroplating, mengekstrak logam tulen dari aloi dan sebagainya.
Galvanic vs. Sel Elektrolytik: Perbandingan dalam bentuk jadual
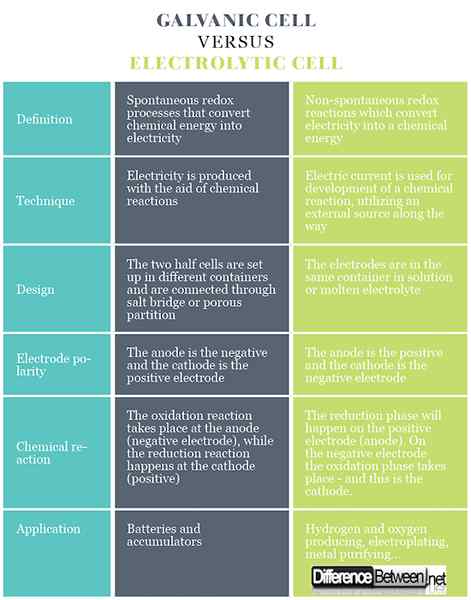
Ringkasan Galvanic vs. Sel elektrolitik
- Sel elektrokimia terdiri daripada dua sel separuh atau elektrod yang hubungannya dibuat melalui elektrolit (konduktor ionik). Sel separuh, jika dipisahkan, boleh disertai oleh jambatan garam (larutan elektrolit pekat dalam gel agar-agar). Sel galvanik menghasilkan arus elektrik berdasarkan perubahan kimia yang berlaku secara spontan di dalamnya. Sel elektrolisis betul -betul sebaliknya: hasil semasa dalam perubahan kimia. Agar sel menjadi galvanik, perubahan kimia spontan mesti berlaku di dalamnya.

