Perbezaan antara molekul dan sebatian
- 3016
- 905
- Ms. Lee Bechtelar
 Molekul vs sebatian
Molekul vs sebatian
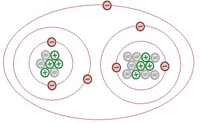
Molekul muncul ketika dua atau lebih atom berinteraksi secara kimia dan bergabung bersama. Kompaun juga merupakan molekul tetapi ia mengandungi atom minimum dua atau lebih elemen. Umumnya semua sebatian boleh dianggap sebagai molekul tetapi molekul bukan kompaun.
Molekul boleh ditakrifkan dengan sewajarnya sebagai sekumpulan atom yang terikat dalam susunan yang pasti. Sebatian adalah perkara yang terdiri daripada lebih daripada satu jenis atom '"dengan kata lain, lebih daripada satu jenis elemen. Semua sebatian tidak terdiri daripada molekul berasingan. Sebagai contoh, natrium klorida (NaCl) adalah garam meja dan sebatian ionik terdiri daripada rantaian natrium Na+ dan Cl- yang tidak, dalam logik ketat perkataan, molekul.
Hanya kita boleh menentukan sebagai '| |
Sebatian adalah bahan yang terdiri daripada dua atau lebih elemen yang mempunyai ikatan kimia antara satu sama lain dalam peratusan kekal dengan jisim. Molekul adalah bahagian terkecil dari sebatian. Satu atau lebih atom yang bersatu secara kimia untuk membentuk molekul. Hidrogen molekul (H2), oksigen molekul (O2) dan nitrogen molekul (N2) bukan sebatian kerana masing -masing terdiri daripada satu jenis elemen. Molekul tidak mempunyai caj elektrik pada mereka, dan boleh wujud dalam bentuk pepejal, cecair, atau gas dengan berat dan saiz yang berbeza. Molekul adalah komponen tertentu terkecil di mana bahan tulen dapat dibahagikan dan menyimpan komposisi dan sifat kimianya. Pemisahan menjadi bahagian yang lebih kecil i.E atom, melibatkan menyelesaikan ikatan kimia yang menyatukan molekul bersama. Semua bahan mempunyai urutan diatomik atau polyatomik dalam molekul tidak seperti gas Nobel memasangkan di mana atom tunggal adalah molekul. Atom sama dalam molekul seperti molekul oksigen (O2) mengandungi dua atom oksigen yang terikat secara kimia bersama -sama semasa dalam kompaun molekul yang berbeza bersatu untuk membuat sebatian seperti dalam atom glukosa (c6h12o6) magnitud tetap. Ikatan kovalen antara molekul memberikan mereka bentuk dan sifat tertentu.
Contoh umum molekul dan sebatian:
Metana (CH4), karbon dioksida (CO2) dan air (H2O) adalah salah satu daripada sebatian yang diketahui yang terdiri daripada unsur -unsur. Air adalah sebatian yang terdiri daripada molekul hidrogen dan oksigen oleh itu dalam sebatian yang disebutkan di atas zarah terkecil ditakrifkan sebagai molekul dan subdivisi selanjutnya membawa kepada pemecahan ikatan antara molekul dan dengan cara ini dibentuk. Molekul gas adalah oksigen, helium, dan nitrogen; sedangkan contoh molekul pepejal adalah perak (SI), dan uranium (u). Mercury (HG) hanya molekul perak logam cecair.
Sebatian boleh diiktiraf oleh formula kimia mereka yang mengenal pasti molekul yang digabungkan untuk membuat sebatian. Kompaun yang paling terkenal ialah H2O, yang merupakan gabungan dua molekul hidrogen dan satu molekul oksigen; biasanya dikenali sebagai air. Satu lagi garam meja kompaun yang paling biasa dikenal pasti oleh formula NaCl, yang merupakan gabungan satu molekul natrium dan satu molekul klorin. Apabila sebatian terdiri daripada molekul yang berbeza, tindak balas kimia berlaku untuk menghasilkan perubahan dalam molekul, dan unsur -unsur stabil menjadi bentuk baru dengan sifat, warna dan bentuk yang berbeza. Molekul yang hanya mempunyai satu jenis atom, seperti O2, iaitu oksigen, ia tidak dianggap sebagai sebatian; Kerana menjadi sebatian, ia mesti perlu menggabungkan dengan jenis atom yang berbeza untuk membentuk sebatian.
Molekul boleh diiktiraf oleh berat, saiz dan pengaturan mereka. Kita boleh memisahkan molekul semasa tindak balas kimia, dan menggabungkannya untuk menghasilkan molekul yang lebih besar, atau seseorang dapat menggabungkan beberapa molekul dengan jenis molekul yang berlainan untuk membentuk sebatian.
Ringkasan:
1. Komposisi molekul berlaku dengan gabungan satu atau lebih atom dan molekul boleh wujud dalam keadaan pepejal, cecair atau gas. Sebaliknya sebatian terdiri daripada gabungan molekul yang berlainan sehingga molekul dianggap sebagai komponen penting dalam sebatian.
2. Molekul diiktiraf oleh berat dan saiz mereka, dan boleh bersatu untuk membentuk molekul yang lebih besar, atau dipisahkan oleh reaksi kimia.
3. Molekul dalam sebatian dikikat secara kimia bersama.
4. Sebatian dikenal pasti oleh formula seperti H2SO4, NaCl dan H2O
5. Contoh molekul yang terkenal ialah hidrogen, oksigen, emas, atau ammonia.
6. Beberapa contoh sebatian biasa adalah asid hidroklorik karbon, natrium bikarbonat dan glukosa.
7. Sebatian menunjukkan sifat kimia dan fizikal yang berbeza berbanding dengan molekul komponen mereka.
Rujukan:
Kandungan bertulis di atas adalah dalam bentuk asal dan unik dan membantu menulis artikel diambil dari sumber -sumber berikut (hanya untuk tujuan maklumat) dan artikel telah ditulis dalam format yang benar -benar baru dan unik dan akan hanya pemilikan majikan:-
a.Kimia Organik / Bukan Organik (Buku Kursus Tahap Pengijazahan di Universiti Punjab Lahore Pakistan).

