Perbezaan antara ikatan kovalen bukan polar dan kutub
- 5098
- 289
- Gilbert Schumm

Bukan polar vs. Ikatan kovalen kutub
Ikatan kovalen bukan polar dan kutub kedua-duanya tergolong dalam tiga kategori polariti serta dua jenis ikatan kovalen. Ketiga jenis (ionik, kutub, dan bukan polar) diklasifikasikan sebagai ikatan kimia di mana terdapat daya (elektronegativiti) yang membolehkan tarikan atom dua unsur tertentu. Bilangan ikatan kovalen yang mungkin ditentukan oleh bilangan kekosongan dalam shell elektron luar elemen tertentu.
Untuk beberapa pertimbangan, tiga kategori polariti atau bon adalah bon ionik dan ikatan kovalen. Klasifikasi lanjut mengenai ikatan kovalen mendedahkan kedua -dua jenis ini. Kedua-dua ikatan kovalen bukan polar dan kutub berlaku dalam dua elemen yang berbeza dan bukan logam. Kedua -dua klasifikasi juga berurusan dengan pengedaran dan perkongsian elektron serta elektronegativiti yang dihasilkan.
Apabila dua elemen menggabungkan, beberapa elektron dari kedua -dua elemen boleh dipindahkan antara satu sama lain. Elektronegativiti, atau keupayaan satu elemen untuk menarik dan menangkap elektron elemen lain, adalah penting dalam menentukan jenis ikatan antara kedua -dua elemen. Pemindahan atau tarikan boleh menyebabkan perkongsian sama atau perkongsian elektron yang tidak sama rata.
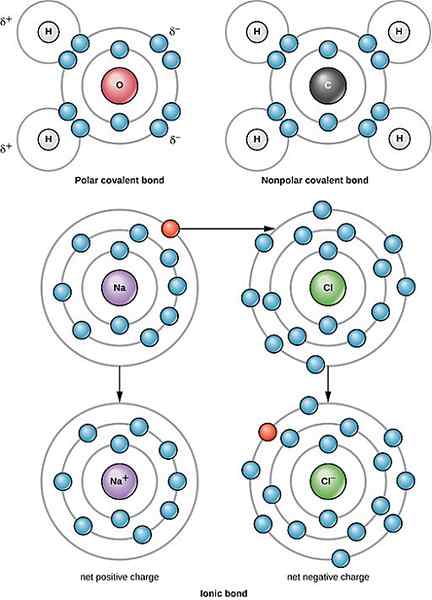
Bon kovalen kutub dicirikan oleh atom dengan nombor yang tidak rata atau tidak sama rata atau perkongsian elektron antara kedua -dua elektron. Elektronegativiti kedua -dua elemen adalah berbeza dan tidak sama. Satu lagi ciri ikatan kovalen kutub mempunyai molekul dengan caj negatif di satu pihak dan caj positif di pihak yang lain. Caj separa juga merupakan sifat yang menentukan ikatan kovalen tertentu ini.
Molekul dalam jenis ikatan ini juga mempunyai paksi (atau paksi) yang ditentukan secara positif dan separa negatif. Sebaliknya, ikatan kovalen bukan polar mempunyai perkongsian atau pengedaran elektron yang sama atau hampir sama antara dua elemen. Ikatan kovalen bukan polar tidak mempunyai paksi atau paksi yang ditetapkan berbanding dengan ikatan kovalen kutub.
Apabila diletakkan pada skala klasifikasi, ikatan ionik (ikatan yang wujud antara logam dan bukan logam) mempunyai elektronegativiti dan polariti yang paling banyak. Ikatan ionik diikuti oleh ikatan kovalen kutub dan, akhirnya, ikatan kovalen bukan polar. Ikatan kovalen kutub boleh dianggap sebagai sebahagian ionik kerana ia masih boleh mempunyai polariti. Sementara itu, ikatan kovalen bukan polar adalah bertentangan dengan ikatan ionik. Oleh kerana unsur-unsur dalam ikatan kovalen bukan polar tidak mempunyai kemungkinan untuk menarik atau menarik elektron dari elemen lain, tidak ada kemungkinan untuk menarik elektron lain dari elemen lain.
Ringkasan:
1.Ikatan kovalen kutub dan bukan polar adalah dua jenis bon. Kedua -duanya berada di bawah kategori jenis bon yang juga termasuk ikatan ionik.
2.Bon kovalen (bukan polar dan kutub) diklasifikasikan sebagai ikatan yang berlaku dalam unsur-unsur bukan logam, sementara ikatan ionik berlaku dalam gabungan unsur-unsur logam dan unsur-unsur bukan logam.
3.Beberapa konsep yang berkaitan mengenai ikatan kovalen kutub dan ikatan bukan kovalen adalah elektronegativiti (atau pengukuran bagaimana dua elemen berkongsi atau mengedarkan elektron dalam satu sama lain) dan polariti.
4.Ikatan kovalen kutub dicirikan dengan mempunyai pengagihan elektron yang tidak sama rata dari dua elemen. Mereka juga mengekalkan tiang positif dan negatif, yang membolehkan mereka mempunyai elektronegativiti tertentu. Sebaliknya, ikatan kovalen bukan polar digambarkan sebagai mempunyai elektron yang sama atau hampir sama dari segi bilangan elektron. Ciri ini menjadikan mereka tidak mempunyai elektronegativiti.
5.Ikatan kovalen kutub mempunyai paksi atau paksi yang ditetapkan, sementara ikatan kovalen bukan polar kekurangan ciri tertentu ini.
6.Ikatan kovalen kutub mempunyai caj (daripada mempunyai kutub positif dan negatif), manakala ikatan kovalen bukan polar kekurangan caj.

