Allotropes vs. Isomer

- 3235
- 412
- Dr. Anthony Turcotte
Allotropes adalah pengubahsuaian struktur yang berbeza dari elemen isomer adalah sebatian kimia yang berkongsi formula molekul yang sama tetapi mempunyai formula struktur yang berbeza.
Unsur -unsur tertentu boleh wujud dalam dua atau lebih bentuk yang berbeza. Bentuk ini dipanggil allotropes di mana atom elemen terikat bersama dengan cara yang berbeza. Sebagai contoh, dioxygen (o2), ozon (o3), tetraoxygen (o4) dan oktaoksigen (o8) adalah allotropes oksigen. Contoh lain ialah karbon yang allotropes termasuk grafit dan berlian. Singkatnya, allotropes mengandungi elemen yang sama (atom yang sama) yang ikatan bersama dengan cara yang berbeza untuk menghasilkan struktur molekul yang berbeza.
Berbeza, isomer adalah sebatian (Lihat Elemen vs. Sebatian) yang berkongsi formula molekul yang sama tetapi mempunyai formula struktur yang berbeza. Isomer tidak berkongsi sifat kimia mereka kecuali mereka tergolong dalam kumpulan berfungsi yang sama. Sebagai contoh, propanol mempunyai formula c3H8O (atau c3H7OH) dan berlaku sebagai dua isomer: propan-1-ol (alkohol n-propil; I) dan propan-2-ol (isopropil alkohol; Ii). Perbezaan antara kedua-dua isomer terletak pada kedudukan atom oksigen: ia dilampirkan pada karbon akhir dalam propan-1-ol, dan ke karbon pusat dalam propan-2-ol. Terdapat isomer ketiga c3H8O sifatnya sangat berbeza sehingga ia bukan alkohol (seperti propanol) tetapi eter. Dipanggil methoxyethane (metil-etil-eter; Iii), isomer ini mempunyai oksigen yang disambungkan ke dua karbon dan bukannya satu karbon dan satu hidrogen.
Carta Perbandingan
| Allotropes | Isomer | |
|---|---|---|
| Definisi | Allotropes adalah pengubahsuaian struktur yang berbeza dari elemen. Contohnya O dan O2 | Isomer adalah sebatian kimia yang berkongsi formula molekul yang sama tetapi mempunyai formula struktur yang berbeza. |
| Contoh | Berlian, grafit dll. | 2-methylpropan-1-ol dan 2-methylpropan-2-ol. |
Sejarah Allotropes dan Isomer
Kedua -dua allotropy dan isomerisme adalah konsep yang dicadangkan oleh saintis Sweden Jöns Jakob Berzelius. Dia mencadangkan konsep allotropy pada tahun 1841. Selepas penerimaan hipotesis Avogadro pada tahun 1860, difahami bahawa unsur -unsur boleh wujud sebagai molekul polyatomik, dan kedua -dua allotropes oksigen diiktiraf sebagai o2 dan o3. Pada awal abad ke -20 diakui bahawa kes -kes lain seperti karbon adalah disebabkan oleh perbezaan struktur kristal.
Isomerisme mula -mula diperhatikan pada tahun 1827, ketika Friedrich Woehler menyediakan asid sianik dan menyatakan bahawa walaupun komposisi unsurnya sama dengan asid fulminic (disediakan oleh Justus von Liebig pada tahun sebelumnya), sifatnya agak berbeza. Temuan ini mencabar pemahaman kimia yang berlaku pada masa itu, yang memegang sebatian kimia mungkin berbeza hanya apabila mereka mempunyai komposisi unsur yang berbeza. Selepas penemuan tambahan yang sama dibuat, seperti penemuan Woehler 1828 bahawa urea mempunyai komposisi atom yang sama seperti ammonium sianat yang berbeza secara kimia, Jöns Jakob Berzelius memperkenalkan istilah tersebut isomerisme untuk menggambarkan fenomena.
Jenis isomer
Kelas isomer yang berbeza termasuk stereoisomer, enantiomer dan isomer geometri.
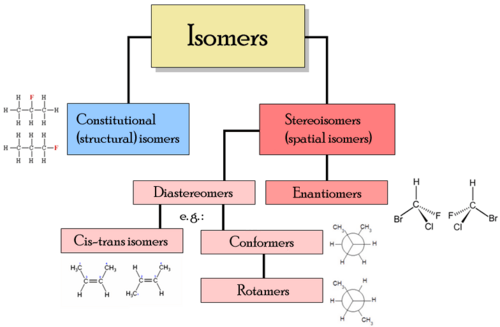 Jenis isomer
Jenis isomer - Isomer struktur - Dalam isomer struktur, atom dan kumpulan berfungsi disatukan dengan cara yang berbeza. Jenis isomer struktur termasuk:
- isomerisme rantai - Rantaian hidrokarbon mempunyai jumlah cawangan yang berubah -ubah
- kedudukan isomerisme - berurusan dengan kedudukan kumpulan berfungsi di rantai
- Isomerisme kumpulan berfungsi - satu kumpulan berfungsi berpecah kepada yang berbeza.
- Isomer rangka - Rantaian karbon utama berbeza antara kedua -dua isomer.
- Tautomers - isomer struktur bahan kimia yang sama yang secara spontan saling beralih antara satu sama lain.
- Stereoisomer - Dalam stereoisomer struktur ikatan adalah sama, tetapi kedudukan geometri atom dan kumpulan berfungsi di ruang adalah berbeza. Jenis stereoisomer termasuk:
- enantiomer - Isomer yang berbeza adalah imej cermin yang tidak dapat diselesaikan antara satu sama lain
- Diastereomers - isomer bukan imej mirro antara satu sama lain

