Perbezaan antara adiabatik, isotermal dan isobaric
- 3597
- 586
- Mrs. Tomas Champlin

Apa itu Adiabatik?
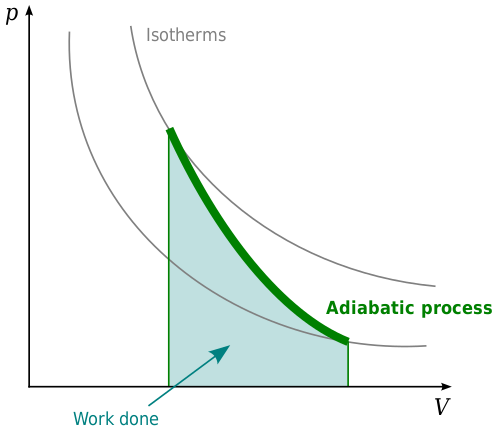
Sistem atau proses adiabatik adalah satu di mana tidak ada perubahan bersih tenaga haba. Proses adiabatik berkaitan dengan undang -undang termodinamik pertama. Undang -undang ini menyatakan bahawa apabila tenaga haba dimasukkan ke dalam sistem, ia akan mengubah tenaga dalaman sistem atau ia akan berfungsi. Ini berkaitan dengan undang -undang pemuliharaan tenaga yang menyatakan bahawa perkara dan tenaga tidak dapat dibuat atau dimusnahkan. Dalam konteks termodinamik, tenaga haba dalam sistem mesti melakukan sesuatu. Sama ada akan mengubah tenaga dalaman sistem, kerja, atau gabungan kedua -duanya. Ia tidak boleh hilang.
Dalam sistem, tekanan, kelantangan, dan suhu adiabatik akan berubah sedemikian rupa sehingga tenaga haba tetap tetap. Proses adiabatik paling jelas dilihat dalam gas. Pemanasan adiabatik dalam gas akan menyebabkan suhu meningkat apabila tekanan pada gas meningkat. Jika tekanan pada gas berkurangan, ini akan menyebabkan suhu jatuh, mengakibatkan penyejukan adiabatik. Dengan pemanasan adiabatik, gas akan dimampatkan dan dengan itu kerja akan dilakukan pada gas oleh alam sekitar. Sekiranya penyejukan adiabatik berlaku, ini akan mengakibatkan gas berkembang dan gas akan berfungsi di alam sekitar.
Contoh di mana proses adiabatik penting adalah dalam konteks omboh, seperti omboh dalam enjin diesel. Apabila tekanan dari omboh meningkat, gas akan berkontrak. Dengan penyahmampatan, gas akan berkembang lagi, menggerakkan omboh. Ini dikawal oleh proses adiabatik.
Proses adiabatik penting dalam meteorologi. Sekiranya bungkusan udara meningkat, tekanan ke atas bungkusan udara akan berkurangan dan ini akan menyebabkan suhu udara menurun disebabkan oleh penyejukan adiabatik. Sebaliknya, jika pesawat udara ditolak ke tanah, ia akan menyebabkan tekanan pada udara meningkat, memanaskan badan udara. Kerana tekanan udara berkurangan dengan ketinggian, suhu akan berkurang dengan ketinggian di atmosfera. Kadar di mana suhu berkurangan dengan ketinggian yang semakin meningkat dikenali sebagai kadar luput adiabatik.
Apa itu Isothermal?
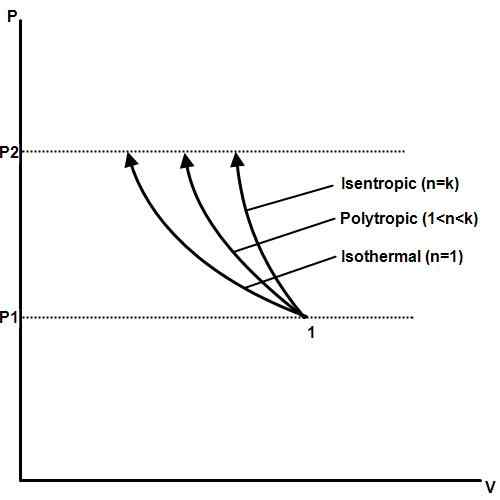
Proses isoterma adalah satu di mana suhu tetap malar walaupun tekanan dan perubahan kelantangan. Dalam termodinamik, tekanan, suhu, dan kelantangan berkaitan dengan undang -undang gas Boyle. Sekiranya seseorang dipertahankan, yang lain akan berubah secara berkadar antara satu sama lain. Sekiranya suhu gas tetap berterusan, tekanan dan jumlah gas akan berkadar songsang.
Contoh proses isoterma adalah perubahan fasa. Apabila bahan, seperti air, mencapai titik lebur atau titik mendidih, tekanan dan suhu akan tetap malar kerana fasa, kelantangan, dan perubahan tenaga haba.
Proses isoterma membentuk asas enjin haba yang digunakan dalam loji kuasa elektrik, kereta, kapal terbang, roket, dan mesin lain yang penting untuk tamadun moden. Proses isothermal juga penting dalam biologi, geologi, sains angkasa, sains planet, dan banyak bidang lain.
Apa itu Isobaric?
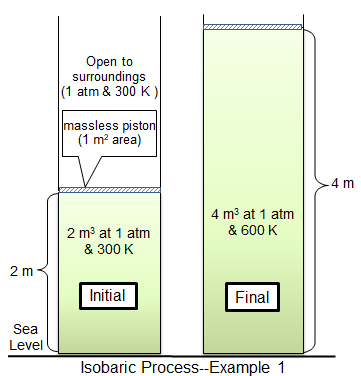
Dalam proses isobaric, tekanan dalam sistem tetap berterusan. Di bawah keadaan isobariik, kelantangan dan suhu berkaitan secara langsung. Sekiranya suhu meningkat, begitu juga kelantangan. Ini dapat digambarkan dengan meletakkan belon di dalam peti sejuk. Tekanan di dalam belon dan di luar akan tetap malar, tetapi belon akan mula mengecut dalam jumlah kerana ia menyejukkan.
Contoh lain ialah omboh berwajaran yang dipindahkan oleh gas yang dipanaskan dalam silinder. Apabila gas dipanaskan, suhu gas meningkat, dan gas mengembang, menolak omboh. Sekiranya omboh tetap dan tidak dapat bergerak, tekanan dalam gas akan meningkat dan bukannya gas berkembang dan sistem tidak akan menjadi isobaric.
Proses isobaric penting dalam pembinaan enjin haba kerana enjin haba tertentu bergantung pada proses isobaric untuk menukar tenaga haba menjadi tenaga mekanikal.
Persamaan antara adiabatik vs. isothermal vs. Isobaric
Proses adiabatik, isoterma, dan isobariik semuanya berkaitan dengan tekanan, suhu, dan kelantangan. Mereka juga digambarkan dengan baik dengan gas. Ketiga jenis proses juga paling relevan di atmosfera planet.
Perbezaan antara adiabatik vs. isothermal vs. Isobaric
Walaupun proses ini mempunyai persamaan, mereka juga mempunyai perbezaan penting. Ini termasuk yang berikut.
- Suhu gas akan berkurangan apabila gas berkembang dalam sistem adiabatik, sedangkan suhu akan tetap malar apabila gas berkembang dalam sistem isoterma dan meningkat apabila gas berkembang dalam sistem isobaric.
- Dalam sistem adiabatik atau isoterma, jumlah gas berkadar songsang dengan suhu, sedangkan ia berkadar terus dengan suhu dalam sistem isobaric.
- Tekanan gas berkadar songsang dengan jumlah dalam sistem isoterma, sedangkan ia tidak berubah dalam sistem isobaric, dan tekanan pada gas berkadar songsang dengan jumlah dalam sistem adiabatik.
- Haba tidak berubah dalam sistem adiabatik, sedangkan ia berubah dalam sistem isoterma atau isobaric.
Adiabatik vs. isothermal vs. Isobaric

Ringkasan
Dalam sistem adiabatik, tidak ada perubahan bersih dalam haba. Apabila gas berkembang, suhu akan jatuh, yang membawa kepada penyejukan adiabatik. Sekiranya gas dimampatkan, suhu akan meningkat, yang membawa kepada pemanasan adiabatik. Proses adiabatik penting dalam sains atmosfera. Dalam proses isoterma, suhu adalah malar, dan tekanan dan kelantangan berkait antara satu sama lain. Contoh proses isoterma adalah perubahan fasa. Semasa perubahan fasa, suhu bahan tidak akan berubah walaupun perubahan haba dan kelantangannya. Dalam sistem isobaric, tekanan kekal malar dan jumlahnya akan meningkat atau berkurang dengan suhu. Sekiranya jumlah gas diletakkan di dalam peti sejuk, contohnya, jumlah gas akan berkurang saiz kerana tekanan adalah malar sementara suhunya jatuh.

