Perbezaan antara elektrofil dan nukleofil
- 2817
- 755
- Ricardo Koelpin IV
Elektrofil dan nukleofil adalah dua konsep penting dalam kimia organik yang membantu menggambarkan tindak balas kimia antara penerima elektron dan penderma. Kedua -dua istilah ini diperkenalkan pada tahun 1933 oleh Christopher Kelk Ingold dan mereka berkhidmat sebagai pengganti untuk istilah cationoid dan anionoid yang diperkenalkan pada tahun 1925 oleh a.J. Lapworth.
Sejak itu, kajian yang luas telah dijalankan untuk memahami yang berbeza antara elektrofil dan nukleofil. Artikel ini menafikan perbezaan antara kedua -dua konsep ini. Ringkasnya, nukleofil adalah penderma elektron manakala elektrofil adalah penerima elektron.
Apa itu elektrofil?
Untuk memecahkan istilah, perkataan "elektro" adalah dari elektron dan perkataan Latin "phile" merujuk kepada "penyayang". Secara ringkas, ini bermaksud penyayang elektron. Ia adalah reagen yang dicirikan dengan ketumpatan rendah elektron dalam shell valancenya, dan, oleh itu, bertindak balas dengan molekul berkepadatan tinggi, ion atau atom untuk membentuk ikatan kovalen. Ion hidrogen dalam asid dan metil-karbokation adalah contoh bahan elektrofilik. Mereka kekurangan elektron.
Elektrofil mudah dikesan dengan caj positif atau caj neutral dengan orbital kosong (tidak memenuhi peraturan oktet). Elektron bergerak dari kawasan ketumpatan tinggi ke yang mempunyai ketumpatan rendah, dan tidak seperti caj menarik antara satu sama lain. Teori ini menerangkan tarikan elektron oleh atom elektrofil yang kekurangan elektron, molekul atau ion. Secara definisi, elektrofil secara bergantian dipanggil asid Lewis kerana ia menerima elektron sejajar dengan definisi asid.
Reaksi dan sebatian di bawah menunjukkan contoh elektrofil:

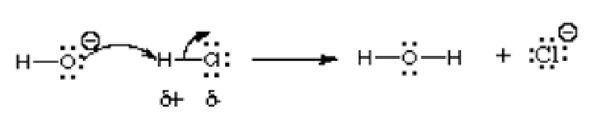
Dalam tindak balas ini, ion hidroksida bertindak balas dengan hidrogen klorida; Oleh itu, asid bertindak balas dengan asas. Seperti yang ditunjukkan oleh anak panah, atom oksigen elektronegatif yang lebih banyak menyumbangkan elektron ke atom hidrogen kekurangan elektron. Ia berkongsi pasangan tunggal ke atom hidrogen yang mempunyai caj positif dalam hidrogen klorida kompaun kerana lebih banyak elektronegatif daripada hidrogen. Reaksi ini adalah asas reaksi kimia organik, terutamanya asid Lewis dan reaksi asas Lewis. Contoh lain digambarkan dalam gambar berikut:
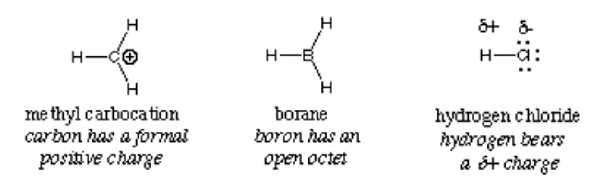
Secara umum, elektrofil dikenal pasti oleh caj positif separa seperti dalam hidrogen klorida, caj positif formal seperti dalam metil karbokation atau orbital kosong. Molekul neutral polarisasi seperti acil halida, sebatian karbonyl, dan alkil halida adalah contoh biasa elektrofil.
Penting: Ion hidronium, walaupun ia mempunyai caj positif, tidak layak dikelaskan sebagai elektrofil kerana orbital kosong penuh di dalam kerang luarnya. Ia menghasilkan ion hidrogen dan air. Begitu juga dengan ion ammonium; ia tidak mempunyai orbital kosong yang dapat menarik elektron. Akibatnya, ia bukan elektrofil.
Apa itu nukleofil?
Istilah ini dipecahkan kepada perkataan "nukleo" yang merujuk kepada nukleus dan perkataan Latin "phile" yang bermaksud penyayang. Itu hanya bermaksud penyayang nukleus. Nukleofil kaya dengan elektron dan, dengan itu, mendermakan pasangan elektron kepada elektrofil untuk membentuk ikatan kovalen dalam tindak balas kimia. Bahan -bahan ini paling baik diperhatikan dengan pasangan tunggal, ikatan PI dan caj negatif. Ion ammonia, iodida dan hidroksida adalah contoh bahan nukleofil.
Secara definisi, nukleofil secara bergantian dipanggil pangkalan Lewis kerana mereka semua menyumbangkan elektron dan menerima proton. Gambar di bawah menggambarkan contoh nukleofil:
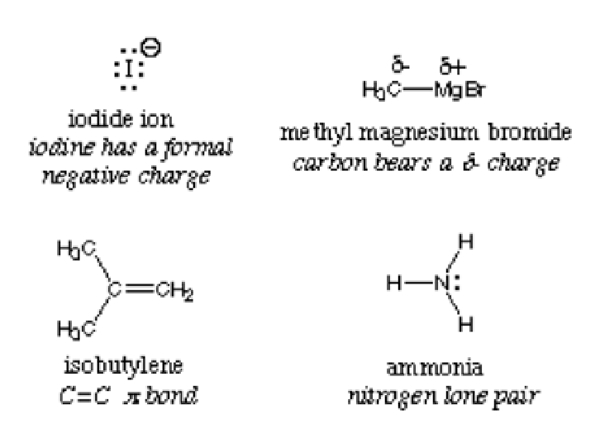
Pusat nukleofilik dalam sebatian dikesan dengan atom elektronegatif yang paling. Pertimbangkan Ammonia NH3; Nitrogen lebih elektronegatif dan dengan itu menarik elektron ke pusat. Kompaun mempunyai ketumpatan elektron yang tinggi dan, apabila bertindak balas dengan elektrofil, katakan air, ia menyumbangkan elektron. H2O boleh bertindak sebagai elektrofil atau nukleofil bergantung pada sebatian atau molekul yang bertindak balas dengan.
Pertimbangkan gambar di bawah:
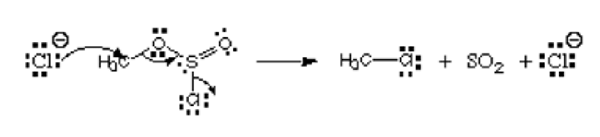
Dari gambar, atom pertama, ion klorida menderma pasangan tunggalnya kepada karbon untuk membentuk ikatan kovalen. Ia mempunyai caj negatif dan menderma elektron, dan oleh itu dianggap sebagai nukleofil. Atom klorin yang meninggalkan ester chlorosulfite dinamakan kumpulan meninggalkan. Ia bukan elektrofil atau nukleofil.
Perbezaan utama antara elektrofil dan nukleofil
Definisi elektrofil dan nukleofil
Elektrofil adalah asid Lewis yang menerima elektron dari atom, ion atau molekul yang kaya dengan elektron. Dengan menerima elektron, ia membentuk ikatan kovalen. Reagen ini sering dikenal pasti oleh caj positif separa, caj positif formal atau atom neutral, ion atau molekul yang tidak memenuhi peraturan oktet. Sebaliknya, nukleofil adalah atom, ion atau molekul yang mempunyai ketumpatan tinggi elektron. Ia menyumbangkan pasangan tunggal kepada elektrofil untuk membentuk ikatan kovalen. Ia dikenal pasti dengan caj positif dan elektron bebas di orbitalnya.
Reaksi kimia elektrofil dan nukleofil
Nukleofil terlibat dalam penggantian dan penambahan nukleofilik manakala elektrofil terlibat dalam penggantian dan penambahan elektrofilik.
Mengenakan identiti dalam elektrofil dan nukleofil
Elektrofil boleh dikenakan secara neutral atau positif manakala nukleofil boleh dicas secara neutral atau negatif. Elektrofil menerima elektron oleh itu ia disebut sebagai asid Lewis sedangkan nukleofil menyumbangkan elektron oleh itu ia disebut sebagai pangkalan Lewis.
Nukleofil Verses Electrophile: Carta Perbandingan

Ringkasan ayat elektrofil nukleofil
- Elektrofil adalah atom kekurangan elektron, ion atau molekul manakala nukleofil adalah atom kaya elektron, molekul atau ion
- Elektrofil boleh dicas secara positif atau neutral manakala nukleofil boleh dikenakan secara negatif atau neutral
- Elektrofil dipanggil asid Lewis dan nukleofil dipanggil asas Lewis
- Elektrofil menerima elektron dan menderma proton sementara nukleofil menyumbangkan elektron dan menerima proton.

