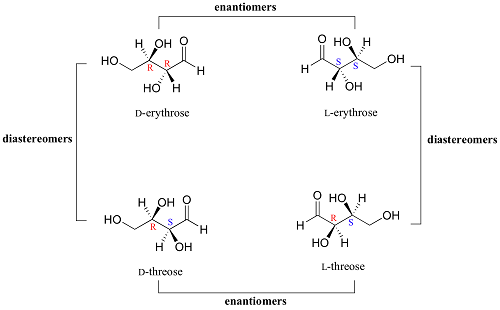
Perbezaan antara enantiomer dan diastereomer
- 3173
- 1005
- Ricardo Koelpin IV

Cabaran banyak pelajar kimia yang mempelajari stereokimia muncul dalam perbezaan antara enantiomer dan diastereomer. Ini adalah sebatian molekul biasa dengan ciri -ciri yang berbeza walaupun menjadi stereoisomer - sebatian dengan formula molekul dan struktur yang sama tetapi orientasi atom yang berbeza. Artikel ini akan menghuraikan perbezaan antara kedua -dua sebatian biasa ini untuk mencerahkan anda.
Pertama, apakah stereokimia? Ini adalah kajian susunan spatial atom di sebatian. Enantiomer dan diastereomer adalah sebahagian daripada stereoisomer - formula struktur dan molekul yang sama dengan susunan atom yang berbeza di setiap satu. Perhatikan bahawa stereoisomer boleh merangkumi banyak sebatian selain daripada enantiomer dan diastereomer. Ini termasuk pengendali dan atropisomer. Antara lain, tumpuan kami adalah pada diastereomer dan enantiomer.
Apa itu enantiomer?
Ini adalah molekul kiral yang merupakan imej cermin antara satu sama lain, dan tidak boleh diserap. Molekul kiral mempunyai imej yang tidak sama dengan imej cerminnya dan ia biasanya dicirikan oleh pusat karbon dengan 4 atom yang berbeza yang terikat kepadanya. Atom -atom ini mesti dibezakan secara kimia untuk molekul yang layak sebagai kiral dan dengan itu enantiomer. Karbon tetrahedral yang mana atom yang berlainan dilampirkan dipanggil stereocenter. Lihat perbezaan di bawah antara karbon yang dianggap sebagai kiral dan yang tidak layak.
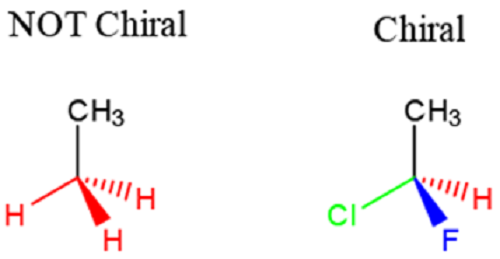
Rajah 1: Ilustrasi molekul kiral dan bukan khiral [1]
Kerana terdapat sedikit perbezaan dalam susunan ruang atom molekul enantiomer, Cahn-ingold-prelog sistem penamaan telah ditubuhkan. Kedua -dua molekul mempunyai formula yang sama dan penstrukturan atom supaya dapat mengenal pasti mereka, kita harus melabelkan satu s dan r yang lain, bergantung pada konfigurasi jam mengikut arah atom dari jisim atom terendah hingga jisim atom tertinggi. Sebagai contoh, karbon stereosenter dengan bromin, klorin, fluorin dan hidrogen yang dilampirkan masing-masing dalam arah jam, molekul akan diberikan R, dan jika anti-arah jam, molekul akan diberikan S kerana bromin mempunyai jisim atom tertinggi dan Hidrogen yang paling rendah.
Susunan atom -atom ini sebenarnya membantu menentukan sifat -sifat molekul. Pertimbangkan struktur bromochlorofluromethane di bawah:
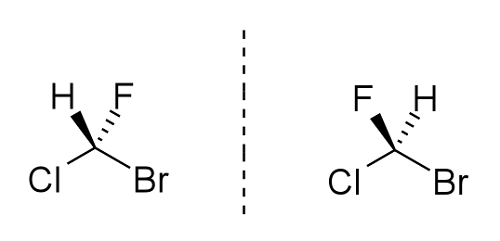
Jelas bahawa orientasi hidrogen dan fluorin berbeza tetapi dari sebatian molekul yang sama. Tidak kira berapa kali anda boleh memutar molekul yang betul, ia tidak akan mempunyai orientasi yang sama seperti molekul kiri. Jika, sebagai contoh, anda cuba menukar fluorin dan hidrogen sekitar, bromin dan klorin juga akan mengubah kedudukan mereka. Ini jelas menerangkan konsep enantiomer yang tidak dapat disimpulkan dan cermin.
Untuk menamakan molekul, kiral (stereocenter) diberikan huruf s atau r. Konstituen, oleh itu fluorin, klorin, bromin, dilabelkan dari jisim atom yang tinggi hingga rendah 1, 2, 3. Bromin adalah yang tertinggi SO ditugaskan 1, klorin 2 dan fluorin 3. Sekiranya putaran adalah 1 hingga 3 di arah jam maka pusat kiral ditetapkan r, jika berlawanan arah jam, maka s. Begitulah cara sistem cahn-ingold-prelog berfungsi dalam membezakan enantiomer antara satu sama lain. Ia menjadi mudah apabila kita bekerja dengan satu pusat kiral dengan 4 substituen unik yang melekat padanya. Enantiomer boleh mempunyai lebih daripada 2 pusat kiral.
Molekul enantiomer adalah berbeza dari segi susunan atom spatial, tetapi unik mempunyai sifat kimia dan fizikal yang sama. Yang mengatakan, mereka mempunyai titik lebur yang sama, titik mendidih, dan banyak lagi sifat. Daya intermolecular mereka sama - ini menerangkan sifat yang sama. Tetapi sifat optik mereka berbeza kerana mereka memutar cahaya terpolarisasi dalam arah yang bertentangan walaupun dalam jumlah yang sama. Perbezaan sifat optik ini membezakan molekul enantiomer.
Apakah diastereomers?
Ini adalah sebatian stereoisomer dengan molekul yang tidak cermin imej antara satu sama lain dan yang tidak dapat diselaraskan. Contoh sempurna diastereomer adalah apabila anda melihat struktur cis dan trans isomer. Lihat CIS-2-Butene dan struktur trans-2-butena di bawah:
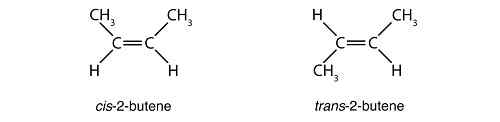
Sebatiannya sama tetapi susunannya berbeza, dan mereka bukan imej cermin antara satu sama lain. Apabila ch3 berada di sisi yang sama, sebatiannya cis Dan apabila yang lain ditukar dengan atom hidrogen, kita namakan sebatian trans. Tetapi yang cis dan trans struktur bukan satu -satunya contoh diastereomer. Terdapat banyak molekul ini, selagi mereka menunjukkan pengaturan spatial atom yang tidak cermin imej antara satu sama lain, dan itu tidak boleh diperkatakan.
Tidak seperti enantiomer, diastereomer mempunyai sifat fizikal dan kimia yang berbeza. Diastereomers mempunyai dua stereoken di mana struktur molekul lain mungkin meniru konfigurasi enantiomer manakala yang lain mempunyai konfigurasi yang sama. Inilah yang membezakannya dari enantiomer kerana tidak ada cara struktur ini dapat mencerminkan imej antara satu sama lain.
Jadual di bawah akan menyerlahkan perbezaan utama antara enantiomer dan diastereomer secara ringkas:
| Enantiomer | Diastereomers |
| Mereka adalah imej cermin antara satu sama lain dan tidak dapat diselesaikan | Mereka bukan cermin imej antara satu sama lain dan tidak dapat disokong |
| Struktur molekul mereka sering direka dengan r dan s untuk membezakannya. | Satu molekul meniru struktur enantiomer manakala yang lain mempunyai konfigurasi yang sama. Jadi tidak perlu menggunakan penamaan untuk membezakannya. |
| Mempunyai sifat kimia dan fizikal yang sama tetapi sifat optik yang berbeza | Mempunyai sifat kimia dan fizikal yang berbeza |
| Mempunyai satu atau lebih stereocenter | Mempunyai dua stereocenters |
| Semua enantiomer mempunyai aktiviti optik aktif walaupun mereka berputar cahaya ke arah yang bertentangan. Orang-orang yang berputar ringan anti-arah jam dikenali sebagai levorotary, dan yang berputar mengikut arah jam dikenali sebagai dextrorotary. Tetapi apabila yang lain mempunyai jumlah putaran dextrorotary dan levorotary yang sama, ia dianggap campuran perlumbaan dan dengan itu tidak aktif secara optik. | Tidak semua diastereomer mempunyai aktiviti optik |
Balut!
Enantiomer dan diastereomer adalah stereoisomer dengan formula molekul dan struktur yang sama tetapi susunan/konfigurasi yang berbeza dari atom yang menjadikan struktur mereka. Kami telah melihat bahawa molekul enantiomer adalah imej cermin antara satu sama lain dan diastereomer bukan imej cermin. Kedua -dua molekul tidak boleh diperbaiki.
Enantiomer mempunyai sifat kimia dan fizikal yang sama tetapi berbeza dengan sifat optik kerana beberapa berputar cahaya terpolarisasi ke arah yang bertentangan. Sebaliknya, tidak semua diastereomer mempunyai aktiviti optik.
Kami juga melihat bagaimana penamaan struktur enantiomer terungkap dengan sistem penamaan R dan S yang diberikan berdasarkan jisim atom substituen yang dilampirkan di pusat kiral. Dalam diastereomers, hanya satu struktur yang mempunyai konfigurasi R dan S manakala yang lain mempunyai konfigurasi yang sama. Inilah yang membezakannya dari imej cermin enantiomer.

