Perbezaan antara titik akhir dan titik kesetaraan
- 3918
- 250
- Ms. Lee Bechtelar
Titik titik akhir dan kesetaraan adalah dua konsep yang paling penting dalam titrasi kimia. Teknik titrasi boleh berlaku dalam tindak balas redoks, tindak balas asid, dan banyak lagi reaksi. Ia digunakan secara besar-besaran dalam tindak balas asid-asas di mana ia melibatkan peneutralan penyelesaian lain dengan yang lain untuk menentukan kepekatan yang tidak diketahui. Pada asasnya, penyelesaian standard dengan kepekatan yang diketahui dengan teliti dicurahkan ke dalam penyelesaian lain yang disebut analit dengan kepekatan yang tidak diketahui untuk mengira kepekatannya.
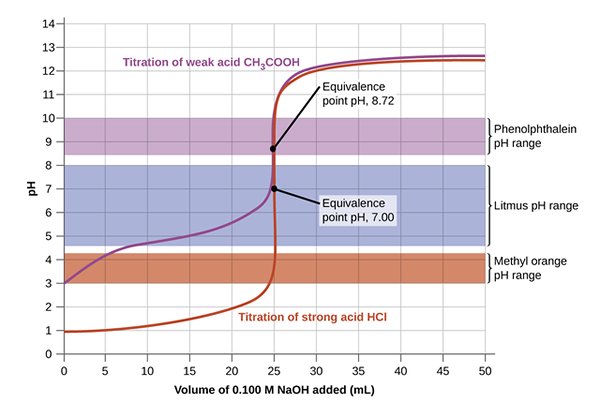
Semasa proses titrasi, terdapat dua peringkat yang dicapai, iaitu. titik titik akhir dan kesetaraan. Titik kesetaraan, juga dipanggil titik stoikiometrik, secara ringkas, adalah titik di mana tahi lalat kedua -dua penyelesaian, asid dan asas, bersamaan atau sama. Peringkat berlaku sebelum titik akhir, yang menandakan penyempurnaan reaksi. Dalam beberapa tindak balas, terdapat banyak titik kesetaraan, terutamanya dalam asid poliprotik dan pangkalan di mana beberapa ion hidroksida wujud.
Artikel ini membentangkan perbezaan utama antara titik akhir dan titik kesetaraan dalam titrasi kimia.

Definisi titik kesetaraan
Titik kesetaraan dalam titrasi asas asid menandakan penyempurnaan tindak balas di mana bilangan tahi lalat titran dan analit adalah sama seperti dalam persamaan kimia. Sebagai contoh, dalam titrasi NaOH dan HCl, 1 mol HCl akan sama dengan 1 mol NaOH pada titik kesetaraan. Titik ini mesti dicapai dengan tepat dengan mentadbir beberapa tetes penyelesaian standard kepada kepekatan yang tidak diketahui. Pipet biasanya digunakan untuk mencurahkan titisan titran ke dalam botol pengukur di mana analit telah dicurahkan dengan penunjuk tertentu. Petunjuk penting dalam titrasi asas asid untuk melihat dengan jelas kesetaraan dan titik akhir.
Asid dan titrasi asas boleh berlaku di antara asas yang kuat dan asas yang lemah; asas yang kuat dan asid lemah; asas yang kuat dan asas yang kuat; atau asid poliprotik yang lemah. Penunjuk yang berbeza boleh digunakan bergantung pada tipikal penyelesaian yang digunakan untuk titrasi. Contohnya, dalam titrasi NaOH dan HCl, phenolphthalein digunakan, sedangkan dalam NH3 dan HCl penunjuk metil oren lebih sesuai untuk mempengaruhi perubahan. Sekiranya pH titran sepadan dengan pH pada titik kesetaraan, titik akhir dan titik kesetaraan boleh berlaku serentak.
Gambar di bawah memberikan pemahaman yang jelas mengenai titrasi yang ditetapkan untuk mencapai titik kesetaraan dan kemudian mencapai titik akhir apabila warna berubah. Pada mulanya, penyelesaian dengan kepekatan yang tidak diketahui dicurahkan dengan penunjuk. Kemudian titran ditambah menggunakan burette dengan mengawal titisan dengan injap. Persamaan masidVasid = MasasVasas digunakan untuk mengira kepekatan yang tidak diketahui oleh manipulasi algebra yang menyatakan bahawa molariti adalah sejumlah tahi lalat seliter.
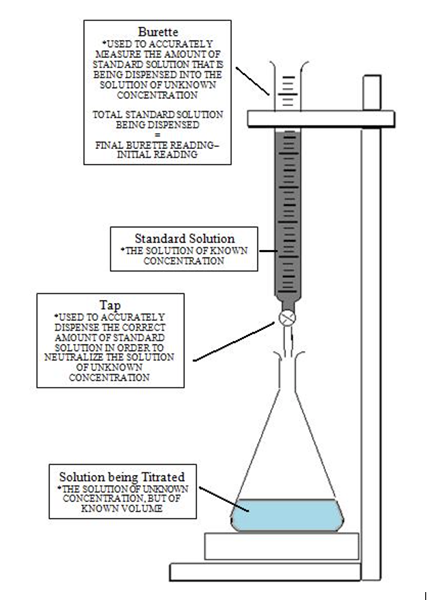
Definisi titik akhir
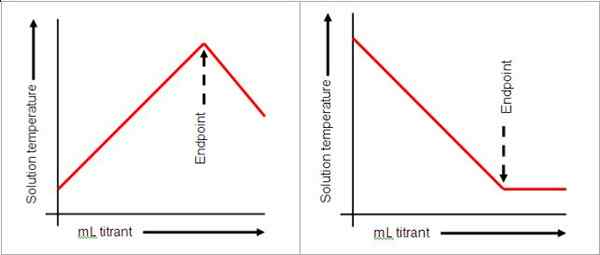
Titik akhir datang selepas titik kesetaraan dalam titrasi. Ia menunjukkan bahawa titik kesetaraan telah dicapai. Titik akhir ini ditunjukkan oleh perubahan warna penyelesaiannya. Lihat gambar di bawah:

Ihsan imej: libeks kimia
Untuk mencapai titik akhir, jumlah titisan harus diberikan dengan teliti kerana satu penurunan dapat mengubah pH penyelesaian. Dalam keadaan di mana titik akhir telah diluluskan, titrasi belakang atau titrasi terbalik boleh dilakukan bergantung kepada sifat penyelesaiannya. Sekiranya terlalu banyak titran telah dicurahkan, titik akhir mungkin diluluskan. Penyelesaiannya adalah untuk menambah penyelesaian lain dari reaktan yang berbeza.
Petunjuk tidak selalu digunakan dalam titrasi. Meter pH boleh digunakan untuk membaca pH sebagai petunjuk bahawa reaksi selesai. Dalam asas dan asid yang kuat, pH 7 menunjukkan bahawa tindak balas selesai. Perubahan warna, bagaimanapun, cara yang mudah untuk memantau titik akhir oleh itu penunjuk sering digunakan. Penyelesaian natrium klorida dan asid hidroklorik mencapai titik akhir seperti yang ditunjukkan oleh phenolphthalein apabila penyelesaiannya menjadi merah jambu. Titik akhir tidak semestinya menunjukkan akhir tindak balas, tetapi penyempurnaan titrasi.
Perbezaan antara titik akhir dan kesetaraan
Definisi titik akhir dan kesetaraan
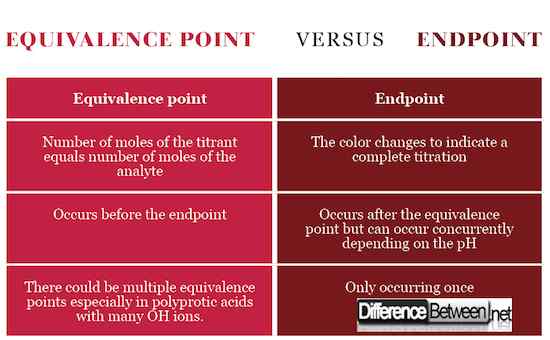
Endpoint adalah tahap dalam titrasi yang ditunjukkan oleh perubahan warna sebagai tanda bahawa titrasi selesai dan titik kesetaraan telah dicapai. Titik kesetaraan, sebaliknya, adalah panggung sebelum titik akhir yang menandakan titik stoikiometrik dengan bilangan tahi lalat yang sama antara analit dan titran sejajar dengan persamaan kimia. Untuk mencapai titik kesetaraan, titran mesti dituangkan dengan tepat dan tepat jatuh dengan penurunan menggunakan burette.
Kejadian titik akhir dan kesetaraan
Titik kesetaraan berlaku apabila bilangan tahi lalat titran, penyelesaian standard, sama dengan bilangan tahi lalat analit, penyelesaian dengan kepekatan yang tidak diketahui. Titik akhir berlaku apabila warna berubah.
Makna titik akhir dan kesetaraan
Titik kesetaraan bermaksud bahawa titran telah bertindak balas sepenuhnya dengan analit sedangkan titik akhir menandakan penyempurnaan titrasi. Titik akhir dan kesetaraan boleh berlaku pada masa yang sama jika pH titran sepadan dengan pH pada titik kesetaraan.
Kesetaraan ayat endpoint: carta perbandingan
Ringkasan kesetaraan ayat endpoint
- Titik titik akhir dan kesetaraan adalah peringkat yang paling penting dalam titrasi kimia
- Titik akhir berlaku selepas titik kesetaraan dan ia menunjukkan penyempurnaan titrasi, tetapi tidak selalu berakhir dengan reaksi.
- Titik kesetaraan berlaku sebelum titik akhir dan ia menunjukkan tindak balas lengkap antara titran dan analit di mana bilangan tahi lalat titran adalah sama dengan bilangan tahi lalat kepekatan yang tidak diketahui
- Titik akhir dicapai apabila warna berubah jika penunjuk telah digunakan
- Asid lemah lain boleh mempunyai banyak titik kesetaraan tetapi hanya satu titik akhir
- Titik kesetaraan juga dipanggil titik stoikiometrik

