Perbezaan antara ikatan hidrogen dan ikatan kovalen
- 3573
- 113
- Dr. Anthony Turcotte

Topik ini menjadikannya sangat jelas bahawa artikel ini berdasarkan beberapa konsep dari kimia. Bagi anda yang mengetahui konsep asas ikatan kimia, mudah difahami bahawa perbincangan adalah kira -kira dua jenis bon. Bagi yang lain, marilah kita katakan bahawa di antara banyak ikatan kimia yang berlaku di antara atom dan molekul, kita akan membincangkan dan membezakan dua jenis bon yang sangat penting, iaitu ikatan hidrogen dan ikatan kovalen.
Sangat kerap bagi orang untuk mengelirukan kedua -duanya. Ini kerana definisi samar -samar yang ditawarkan untuk menjelaskan relatif ini kepada jenis bon lain. Takrif paling mudah yang ditawarkan ialah ikatan antara dua bukan logam biasanya kovalen manakala ikatan antara logam dan bukan logam adalah ionik. Definisi ini agak umum dan terdapat banyak pengecualian dan percanggahan kepadanya. Pertama sekali, perlu diperhatikan bahawa semua bon antara dua bukan logam tidak berada di bawah kategori ikatan kovalen; Terdapat juga ikatan lain, salah satunya adalah ikatan hidrogen.
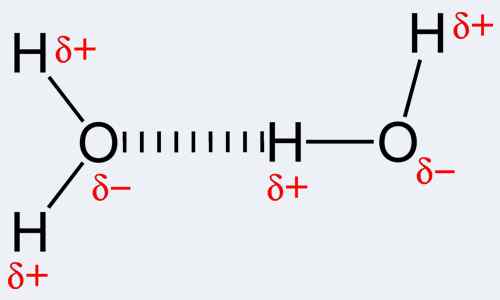
Dengan definisi, ikatan kovalen adalah bentuk ikatan kimia yang berlaku disebabkan oleh perkongsian pasangan elektron antara atom yang sama atau berbeza. Ikatan kovalen, pada gilirannya, merujuk kepada keseimbangan kekerasan yang stabil (baik menarik dan menjijikkan) antara atom ketika mereka berkongsi elektron. Perkongsian membolehkan setiap atom terlibat untuk mencapai shell luar yang bersamaan dengan shell valence penuh atau shell luar. Ini menyumbang konfigurasi elektron yang stabil. Berbeza dengan ini, ikatan hidrogen sebenarnya adalah nama tarikan elektrostatik antara jenis molekul khas, yang dikenali sebagai molekul kutub. Ikatan itu secara unik berlaku apabila atom hidrogen yang sudah terikat kepada atom elektronegatif yang sangat tinggi (salah satu daripada tiga; oksigen, nitrogen atau fluorin) mengalami daya tarikan lain dari atom berdekatan yang juga sangat elektronegatif. Perhatikan bahawa hidrogen mesti berada di sana untuk ikatan hidrogen berlaku, dan oleh itu nama ikatan. Juga, salah satu daripada tiga atom yang disebutkan di atas harus terikat kepadanya. Ini kerana nitrogen, fluorin dan oksigen sangat elektronegatif, iaitu, menarik elektron ke arah diri mereka. Ini menjadikan hidrogen berkelakuan sebagai zarah yang dikenakan positif kerana elektron yang dikenakan negatif telah tertarik kepada atom nitrogen, fluorin atau oksigen yang sepadan. Oleh itu, zarah hidrogen ini, yang kini positif, mudah tertarik ke arah atom elektronegatif yang lain kerana negatifnya. Untuk menggunakan nama hidrogen nama untuk interaksi kimia ini lebih seperti menggunakan salah faham kerana tidak ada ikatan sebenar yang terbentuk. Sebenarnya, terdapat di-tiang untuk tarikan di-tiang.
Interaksi yang berlaku dalam ikatan kovalen termasuk logam ke ikatan logam, tiga pusat dua ikatan elektron, interaksi agostik, ikatan π dan σ-ikatan. Memang ketara bahawa kovalensi adalah yang terbesar antara atom yang mempunyai elektronegativiti yang sama. Ini menunjukkan bahawa kedua -dua atom tidak perlu elemen yang sama tetapi harus mempunyai elektronegativiti yang setanding dan dekat dengan membolehkan ikatan yang lebih kuat. Berbanding dengan ini, ikatan hidrogen adalah intermolecular, iaitu, berlaku di antara molekul atau antara bahagian yang berlainan dari satu molekul. Ikatan hidrogen cukup kuat; lebih kuat daripada kekuatan van der Waals tetapi lebih lemah daripada ikatan kovalen dan ionik. Contoh molekul di mana ikatan hidrogen berlaku termasuk air serta beberapa molekul organik seperti protein, DNA dan lain -lain.
Ringkasan perbezaan yang dinyatakan dalam mata
1. Ikatan kovalen-ikatan kimia yang berlaku disebabkan oleh perkongsian pasangan elektron antara atom yang sama atau berbeza, ikatan kovalen merujuk kepada keseimbangan kekerasan yang stabil (kedua-dua menarik dan menjijikkan) antara atom apabila mereka berkongsi elektron, perkongsian membolehkan setiap atom yang terlibat untuk mencapai mencapai atom cangkang luar yang bersamaan dengan shell valensi penuh atau shell luar; Ikatan hidrogen adalah tarikan elektrostatik antara jenis molekul khas, yang dikenali sebagai molekul kutub. Ikatan itu secara unik berlaku apabila atom hidrogen sudah terikat kepada atom elektronegatif yang sangat
2. Ikatan kovalen boleh berlaku di antara pelbagai atom; ikatan hidrogen memerlukan hidrogen dan salah satu oksigen, nitrogen atau fluorin
3. Ikatan kovalen lebih kuat daripada ikatan hidrogen

