Perbezaan antara ikatan ionik dan kovalen
- 716
- 48
- Ms. Armando Hammes
 Ionic vs kovalen ikatan
Ionic vs kovalen ikatan
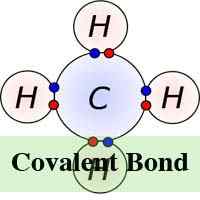
Dalam kimia, molekul dan sebatian dibentuk apabila dua atau lebih atom bersambung antara satu sama lain melalui proses kimia yang dikenali sebagai ikatan. Terdapat dua jenis ikatan kimia '"kovalen dan ionik. Dalam bentuk ikatan kimia ionik, atom -atom yang dikaitkan bersama, berbuat demikian dengan menarik ion yang mempunyai caj yang bertentangan dan bilangan elektron yang ditukar dalam proses mungkin berbeza -beza. Dalam ikatan kimia bagaimanapun, atom berkongsi elektron.
Dalam ikatan ionik, elektron dipindahkan sepenuhnya dari salah satu atom ikatan ke yang lain. Ia adalah kuasa elektrostatik yang menjadikan ion dengan cas bertentangan untuk menarik perhatian antara satu sama lain. Sebagai contoh, dalam ikatan ionik antara natrium dan klorin, natrium kehilangan satu -satunya elektron yang positif dikenakan ke ion klorin yang negatif. Dalam ikatan ionik, atom kehilangan elektron mengecut dan atom yang mendapat elektron tumbuh dalam saiz. Ini tidak begitu dalam ikatan kovalen di mana ion dikongsi bersama. Ikatan kovalen berlaku apabila atom berlaku kerana atom -atom dalam sebatian mempunyai keupayaan yang sama untuk mendapatkan dan kehilangan ion. Oleh itu, ikatan ionik boleh membentuk antara logam dan bukan logam manakala, ikatan kovalen membentuk antara dua bukan logam.
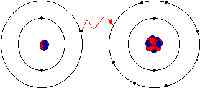 Bon ionik juga boleh dibubarkan di dalam air dan jenis pelarut kutub lain. Juga, sebatian ionik adalah konduktor elektrik yang sangat baik. Ikatan ionik juga membawa kepada pembentukan pepejal kristal dengan suhu lebur yang tinggi. Sebatian ionik juga selalu pepejal.
Bon ionik juga boleh dibubarkan di dalam air dan jenis pelarut kutub lain. Juga, sebatian ionik adalah konduktor elektrik yang sangat baik. Ikatan ionik juga membawa kepada pembentukan pepejal kristal dengan suhu lebur yang tinggi. Sebatian ionik juga selalu pepejal.
Sementara itu, tidak seperti ikatan ionik, ikatan kovalen memerlukan molekul wujud dalam bentuk sebenar mereka dan oleh itu, molekul kovalen tidak tertarik kepada satu sama lain tetapi wujud secara bebas dalam cecair atau gas pada suhu bilik. Ikatan kovalen juga boleh menyebabkan pelbagai ikatan tidak seperti ikatan ionik. Ini kerana sesetengah atom mempunyai keupayaan untuk berkongsi pasangan elektron yang berbilang dengan itu membentuk pelbagai ikatan kovalen pada masa yang sama.

