Perbezaan antara molariti dan molaliti
- 2450
- 739
- Johnnie Purdy
Apa itu molariti?
Molariti boleh ditakrifkan sebagai bilangan tahi lalat bahan (dikenali sebagai larut) yang dibubarkan dalam 1 liter penyelesaian (pelarut dan larut gabungan).
Oleh itu, formula untuk mengira molariti adalah seperti berikut:
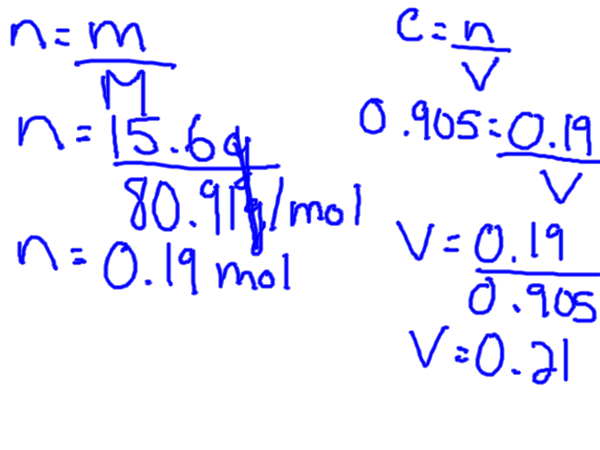
M = larutan larut mol / l
Molariti juga biasanya dirujuk sebagai kepekatan molar. Oleh itu ukuran kepekatan molar berdasarkan jumlah cecair yang bahan dibubarkan. Adalah penting untuk menyedari bahawa jumlahnya dalam liter sehingga anda mungkin perlu menukar terlebih dahulu jika anda mempunyai kelantangan dalam ml sebagai contoh.
Untuk menyediakan kepekatan molar seseorang menambah kuantiti larutan yang diketahui ke dalam botol volumetrik kemudian mengisi kelalang dengan cecair sehingga tanda 1 liter dicapai.

Sebagai contoh: seseorang boleh membuat kepekatan gula molar tertentu. Berat gula terlebih dahulu harus ditukar kepada tahi lalat dan kemudian air ditambah sehingga 1 liter dicapai.
Untuk mengira molariti anda memerlukan larutan dalam tahi lalat, tetapi biasanya anda akan mempunyai berat badan tertentu yang bermaksud anda perlu menukar gram ke dalam tahi lalat. Ini boleh dilakukan dengan mencari jisim molar larut dari jadual berkala.
Formula kepekatan molar dapat disusun semula untuk menyelesaikannya untuk kedua -dua kelantangan dan tahi lalat.
Kelantangan dipengaruhi oleh perubahan suhu atau tekanan. Contohnya, jumlahnya akan meningkat dengan peningkatan suhu. Ini bermakna bahawa terdapat beberapa persoalan ketepatan di mana terdapat perubahan suhu.
Sekiranya suhu berkurang cukup maka cecair mungkin kontrak menyebabkan molariti meningkat kerana bilangan tahi lalat yang sama kekal tetapi akan ada penyelesaian yang kurang.
Sebaliknya, jika suhu meningkat cukup maka cecair dapat berkembang menyebabkan molaritas menurun kerana bilangan tahi lalat yang sama tetap tetapi akan ada lebih banyak penyelesaian yang ada.
Molariti boleh digunakan untuk mengira kepekatan bahan yang telah dicairkan.
Molariti boleh digunakan apabila ketepatan tepat tidak diperlukan. Walau bagaimanapun, ia dipengaruhi oleh perubahan suhu kerana ia adalah pengukuran volumetrik, jadi dalam beberapa kes, ia mungkin tidak sesuai untuk digunakan.
Molariti dan molaliti boleh sama dalam beberapa kes. Contohnya 1 liter air berat 1 kg.
Apa itu Molality?
Molaliti boleh ditakrifkan sebagai bilangan tahi lalat bahan (dikenali sebagai larut) yang terdapat dalam jisim tertentu pelarut yang diberikan dalam kg, yang dibubarkan.
Formula untuk mengira molaliti adalah:
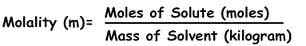
M = Mole Solute / kg pelarut
Molaliti juga dirujuk sebagai kepekatan molal.
Contoh membuat kepekatan molal adalah untuk menaikkan jumlah gula misalnya. Ini kemudian perlu ditukar kepada bilangan tahi lalat menggunakan jisim molekul gula. Biker air kemudian ditimbang dan air ditambah ke bikar sehingga beratnya 1 kg.
Gula kemudian ditambah ke bikar air dan dibubarkan.
Kelebihan molaliti ke atas molaritas adalah bahawa ia tidak terjejas oleh perubahan suhu dan tekanan kerana ia dikira berdasarkan jisim dan bukan kelantangan. Jisim pelarut tidak terjejas oleh suhu dengan cara jumlah bahan, oleh itu molaliti adalah ukuran kepekatan yang lebih tepat daripada molariti.
Dalam kes air molariti dan molaliti mungkin sama sejak 1 liter air berat 1 kg, namun ini mungkin tidak berlaku dengan semua cecair.
Ini bermaksud bahawa molaliti perlu digunakan apabila sifat colligative prihatin.
Molaliti lebih tepat dan memberikan ketepatan yang lebih besar kepekatan tetapi mengambil masa yang lebih lama untuk disediakan kerana larutan harus ditambah kepada berat pelarut. Sekiranya pelarut cair maka ini harus ditimbang.
Ini boleh dilakukan dengan menggunakan sistem gravimetrik dan keseimbangan analisis untuk menimbang pelarut.
Apakah perbezaan antara molariti dan molaliti?
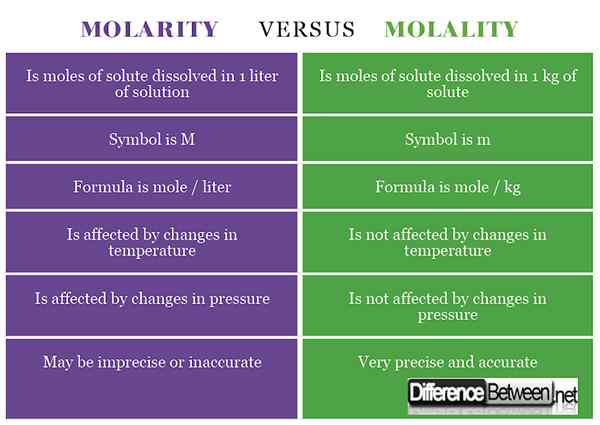
1) Molariti adalah kepekatan bahan yang dikira sebagai bilangan tahi lalat larut yang dibubarkan dalam 1 liter larutan manakala molaliti adalah kepekatan bahan yang dikira sebagai bilangan tahi lalat yang dijumpai dalam 1 kg pelarut.
2) Simbol untuk molaritas adalah m, sementara itu untuk molalitas adalah m (kadang -kadang ditulis sebagai -m atau m untuk membezakannya dari jisim).
3) Formula untuk molariti adalah tahi lalat / liter manakala formula untuk molalitas adalah mol / kg.
4) Molariti dipengaruhi oleh perubahan suhu manakala molaliti tidak terjejas oleh perubahan suhu.
5) Molariti dipengaruhi oleh perubahan tekanan manakala molaliti tidak terjejas oleh perubahan tekanan.
6) Molariti boleh mengakibatkan kepekatan yang tidak tepat dan tidak tepat, sementara molaliti menghasilkan pengukuran tepat yang tepat.
Jadual Membandingkan Molariti dan Molality
Ringkasan Molariti dan Molality
- Kedua -dua molariti dan molaliti boleh digunakan untuk mengukur kepekatan.
- Molariti ditakrifkan sebagai bilangan tahi lalat larut yang dibubarkan dalam 1 liter penyelesaian.
- Molaliti ditakrifkan sebagai bilangan tahi lalat larut yang dibubarkan dalam 1 kg pelarut.
- Molaliti adalah cara yang lebih tepat dan tepat untuk membuat kepekatan tertentu kerana ia tidak terjejas oleh perubahan suhu dan tekanan.
- Molariti melibatkan cecair yang bermaksud bahawa kepekatan dapat berubah. Ini kerana kelantangan menjadi cecair boleh berubah dengan perubahan suhu dan tekanan.
- « Perbezaan antara kecacatan intelektual dan kecacatan perkembangan
- Perbezaan antara Groupby dan Orderby »

