Perbezaan antara tekanan separa dan tekanan wap
- 4031
- 550
- Mrs. Tomas Champlin
Tekanan separa dan tekanan wap biasanya digunakan istilah saintifik yang berkaitan dengan jumlah tekanan yang dikenakan oleh komponen sistem, tetapi identiti mereka dapat mengelirukan orang lain. Terdapat perbezaan yang jelas antara istilah ini termasuk kesan dan identiti mereka. Artikel ini akan menerangkan lebih banyak perbezaan antara istilah ini. Ia juga akan merangkumi beberapa contoh untuk menafikan aplikasi.
Mari kita mulakan dengan menonjolkan konsep tekanan sebelum kita dapat menyelidiki perbezaan antara wap dan tekanan separa. Tekanan ditakrifkan secara saintifik sebagai daya yang digunakan per unit kawasan pada objek atau bahan. Ia juga boleh ditakrifkan sebagai daya yang digunakan oleh zarah berlanggar antara satu sama lain dan ia sering diukur menggunakan Pascal. Sekiranya berlaku perlanggaran zarah, persamaan gas dan teori kinetik gas digunakan untuk mengira tekanan.

Apa itu tekanan wap?
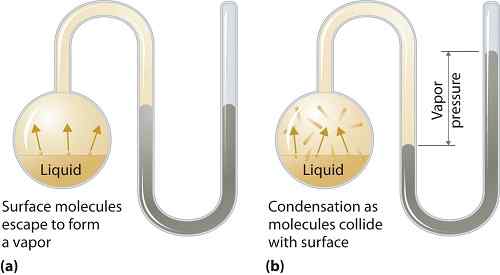
Tekanan wap boleh digunakan untuk fasa cecair atau pepejal. Ia adalah tekanan yang dikenakan oleh wap dalam keseimbangan termodinamik pada keadaan cecair atau pepejal pada suhu tertentu dalam sistem tertutup apabila kedua -dua wap dan cecair (pepejal) bersentuhan. Tekanan ini timbul akibat pengewapan, yang didayakan oleh peningkatan haba pada pepejal atau cecair. Oleh itu suhu digunakan sebagai ukuran pengewapan dan ia berkadar terus dengan tekanan wap. Ini bermakna, semakin tinggi suhu semakin tinggi tekanan wap.
Semasa pengewapan, molekul udara melarikan diri akibat tenaga kinetik yang lebih tinggi ke udara dalam sistem tertutup. Kemudian apabila dalam keseimbangan, tekanan wap timbul antara wap dan bentuk cecairnya yang pekat (pepejal). Dalam penyelesaian di mana daya intermolecular lebih lemah, tekanan wap cenderung lebih banyak, dan, sebaliknya, dalam penyelesaian di mana daya intermolecular lebih kuat, tekanan wap kurang.
Tekanan wap juga boleh berlaku dalam campuran ideal seperti yang dijelaskan oleh undang -undang Raoult. Ia menyatakan bahawa tekanan wap separa komponen tertentu dalam campuran cecair atau pepejal adalah sama dengan tekanan wap komponen yang didarab dengan pecahan tahi lalat dalam campuran pada suhu tertentu. Contoh di bawah akan menggambarkannya.
Contoh 1.
Diberi campuran ideal 0.5 mol. etanol dan 1.5 mol. metanol dengan tekanan wap sebanyak 30kpa dan 52kpa, menentukan tekanan wap separa bagi setiap komponen.
Penyelesaian:
Jumlah tahi lalat ialah 1.5mol + 0.5mol = 2.0mol. Menurut undang -undang Raoult, tekanan wap separa adalah sama dengan tekanan wap yang didarabkan oleh pecahan molar komponen tertentu. Dalam kes ini, pMethanol = 1.5/2 * 52 = 39kpa dan petanol = 0.5/2 * 30 = 7.5kpa.
Apabila anda mempunyai tekanan wap separa komponen dalam campuran, anda boleh mendapatkan tekanan wap jumlah dengan menambahkannya bersama. Dalam hal ini, 7.5 + 39 memberikan 46.Tekanan wap 5kpa campuran campuran etanol dan penyelesaian metanol.
Faktor yang mempengaruhi tekanan wap
Identiti molekul
Seperti yang telah disebutkan di atas, jenis daya molekul menentukan jumlah tekanan wap yang akan dikenakan. Sekiranya daya lebih kuat, maka tekanan wap kurang muncul, dan jika lemah, maka tekanan wap lebih banyak timbul. Oleh itu, komposisi cecair atau pepejal akan menjejaskan tekanan wap.
Suhu
Suhu yang lebih tinggi membawa kepada tekanan wap yang lebih tinggi kerana ia mengaktifkan lebih banyak tenaga kinetik untuk memecahkan daya molekul supaya molekul dapat melepaskan permukaan cecair dengan cepat. Apabila tekanan wap (tekanan wap tepu) sama dengan tekanan luaran (tekanan atmosfera) cecair akan mula mendidih. Suhu yang lebih rendah akan menyebabkan tekanan wap rendah dan ia akan mengambil masa untuk cecair mendidih.

Undang -undang tekanan separa Dalton
Apa itu tekanan separa?
Idea tekanan separa pertama kali dicadangkan oleh saintis terkenal John Dalton. Ia melahirkan undang -undang tekanan separa yang menyatakan bahawa jumlah tekanan yang dikenakan oleh campuran gas yang ideal adalah sama dengan jumlah tekanan separa gas individu. Katakan bekas tertentu dipenuhi dengan gas hidrogen, nitrogen dan oksigen, tekanan keseluruhan, pJumlah, akan sama dengan jumlah oksigen, nitrogen dan hidrogen. Tekanan separa mana -mana gas dalam campuran itu dikira dengan mengalikan jumlah tekanan oleh pecahan molar gas individu.
Ringkasnya, tekanan separa adalah tekanan yang dikenakan oleh gas tertentu dalam campuran seolah -olah ia bertindak sendirian dalam sistem. Oleh itu, anda mengabaikan gas lain ketika menentukan tekanan separa gas individu. Teori ini dapat disahkan dengan suntikan, katakan, 0.6atm o2 dalam 10.0 l bekas pada 230k dan kemudian menyuntik 0.4atm n2 Dalam bekas yang sama dengan saiz yang sama pada suhu yang sama, dan akhirnya menggabungkan gas untuk mengukur jumlah tekanan; ia akan menjadi jumlah kedua -dua gas. Ini jelas menerangkan tekanan separa gas individu dalam campuran gas bukan reaktif.
Mengira tekanan separa
Untuk mengira tekanan separa adalah angin mutlak kerana undang -undang Dalton [1] menyediakan peruntukan untuk itu. Ia bergantung pada maklumat biasa yang diberikan. Jika, sebagai contoh, jumlah tekanan diberikan untuk campuran gas a dan b serta tekanan gas A, tekanan separa b dapat dikira dengan menggunakan pJumlah = PA + PB. Selebihnya adalah manipulasi algebra. Tetapi dalam kes di mana hanya tekanan jumlah campuran telah diberikan, anda boleh menggunakan pecahan molar gas b untuk menentukan adalah tekanan separa. Pecahan molar, yang dilambangkan oleh x, boleh didapati dengan membahagikan tahi lalat gas b dengan jumlah tahi lalat campuran gas. Kemudian untuk mencari tekanan separa, anda akan melipatgandakan pecahan molar, x, dengan jumlah tekanan. Contoh di bawah menghuraikan bahawa.
Contoh 2.
Campuran nitrogen dan oksigen, dengan 2.5 mol dan 1.85 Moles, masing -masing disuntik dalam 20.0L Container dengan tekanan keseluruhan 4atm; Kirakan tekanan separa yang dikenakan oleh gas oksigen.
Penyelesaian:
Jumlah tahi lalat dalam campuran adalah 2.5 + 1.85 = 4.35 Moles. Jadi pecahan molar oksigen, xo, akan menjadi 1.85 mol/4.35 mol = 0.425 Moles. Tekanan separa oksigen akan menjadi 0.425 * 4atm = 1.7atm. Tekanan separa gas baki boleh dikira berikutan pendekatan yang sama atau boleh dikira dengan menggunakan gas oksigen dan jumlah tekanan yang dihuraikan oleh undang-undang tekanan separa Dalton bahawa jumlah tekanan gas tidak reaktif adalah sama dengan jumlah jumlah tekanan separa.
Perbezaan antara wap dan tekanan separa
Dari penjelasan di atas, jelas bahawa tekanan wap dan tekanan separa adalah dua tekanan yang berbeza. Tekanan wap berlaku pada fasa cecair dan pepejal manakala tekanan separa berlaku pada fasa gas. Tekanan wap dikenakan dalam peralihan fasa selepas haba yang mencukupi telah ditambah kepada penyelesaian sehingga membawa kepada molekulnya untuk melarikan diri dalam sistem tertutup.
Perbezaan utama antara tekanan separa dan tekanan wap ialah tekanan separa adalah tekanan yang dikenakan oleh gas individu dalam campuran seolah -olah ia bersendirian dalam sistem itu, sementara tekanan wap merujuk kepada tekanan yang dikenakan oleh wap dalam keseimbangan termodinamiknya dengan keadaan cecair atau pepejal yang dipelopori. Jadual di bawah memberikan perbandingan ringkas tekanan ini.
| Tekanan wap | Tekanan separa |
| Ia dikenakan oleh cecair atau wap pepejal pada fasa pekatnya dalam keseimbangan | Ia dikenakan oleh gas individu dalam campuran gas yang tidak reaktif |
| Dijelaskan dengan baik oleh undang -undang Raoult | Dijelaskan dengan baik oleh undang -undang Dalton |
| Berkenaan dengan fasa pepejal dan cecair | Hanya berlaku dalam fasa gas |
| Bebas dari kawasan permukaan atau jumlah sistem | Dikira menggunakan gas dalam jumlah yang sama |
| Dikira menggunakan pecahan tahi lalat | Dikira menggunakan pecahan tahi lalat gas |
Balut!
Tekanan wap dan tekanan separa adalah dua istilah saintifik penting yang digunakan dalam menentukan kesan daya yang digunakan oleh wap dan gas, masing -masing, dalam sistem tertutup pada suhu tertentu. Perbezaan utama mereka ialah kawasan aplikasi dengan tekanan wap yang digunakan pada fasa cecair atau pepejal, sedangkan tekanan separa digunakan pada gas individu dalam campuran gas ideal dalam jumlah tertentu.
Tekanan separa dikira dengan mudah dengan mengikuti undang -undang tekanan separa Dalton, sedangkan tekanan wap dikira dengan menggunakan undang -undang Raoult. Dalam mana -mana campuran yang diberikan, setiap komponen gas menimbulkan tekanannya sendiri, yang dipanggil tekanan separa bebas daripada gas lain. Dan apabila anda menggandakan tahi lalat dari mana -mana komponen dengan suhu tetap tetap, anda akan meningkatkan tekanan separa. Menurut hubungan Clausius-Clapeyron [2], tekanan wap meningkat apabila suhu meningkat.
Dengan maklumat yang disebutkan di atas, anda harus dapat membezakan antara tekanan wap dan tekanan separa. Anda juga harus dapat mengira mereka menggunakan pecahan molar dan mendarabkan dengan jumlah tekanan. Kami telah memberi anda contoh biasa untuk menghuraikan penggunaan tekanan ini.

