Perbezaan antara asid kuat dan lemah
- 3091
- 579
- Ms. Armando Hammes
Asid adalah bahan kimia yang mendermakan ion hidrogen atau proton apabila bercampur dengan penyelesaian. Bilangan proton yang diberikan oleh asid tertentu sebenarnya menentukan kekuatan asid - sama ada asid kuat atau asid lemah. Untuk memahami kekuatan asid, seseorang perlu membandingkan kecenderungan mereka untuk mendermakan proton ke pangkalan yang sama (kebanyakannya air). Kekuatannya dilambangkan oleh nombor yang dipanggil PKA.

Apa itu asid yang kuat?
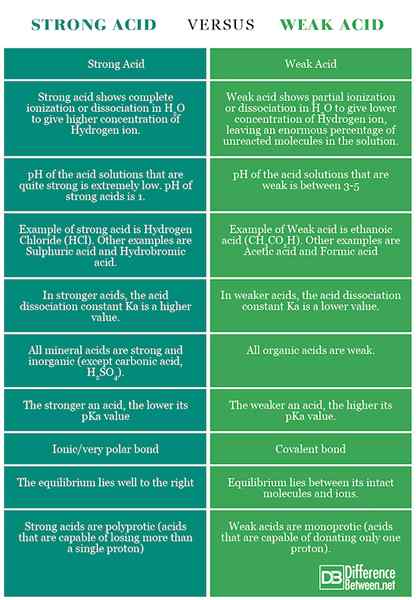
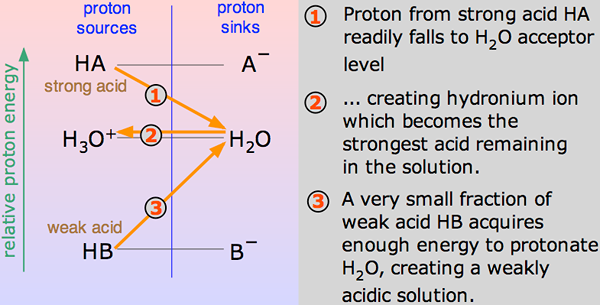
Asid dikatakan kuat jika ia memisahkan atau mengionkan sepenuhnya dalam penyelesaian. Maksudnya, ia dapat memberikan bilangan ion atau proton H+ yang terbesar apabila dicampur dalam penyelesaian. Ion ini adalah zarah yang dikenakan. Oleh kerana asid yang kuat menyumbangkan lebih banyak ion apabila ia pecah, atau mengion, ini bermakna asid yang kuat adalah konduktor elektrik.
Apabila asid bercampur dalam h2O, proton (h+ ion) dibawa ke h2O molekul untuk menjana H3O+ (Ion hidroksonium) dan ion A - berdasarkan asid yang terlibat untuk bermula.
Dalam senario umum,
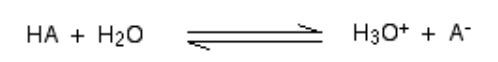
Reaksi kimia sedemikian boleh dihormati, tetapi dalam beberapa kes, asid memberi h+ ion agak mudah dan reaksi kelihatan seperti satu arah. Dan asid lengkap dipisahkan.
Untuk e.g., Apabila hidrogen klorida larut dalam h2O Untuk membuat HCl, begitu sedikit tindak balas terbalik berlaku bahawa kita boleh menulis:

Pada satu masa, seratus peratus reaksi maya akan berlaku di mana hidrogen klorida akan menunjukkan reaksi dengan H3O+ (Ion hidroksonium) dan Cl- ion. Di sini, asid kuat adalah hidrogen klorida.
Apa itu asid lemah?
Asid dikatakan lemah jika ia mengionkan sebahagian atau tidak lengkap, mengeluarkan hanya beberapa atom hidrogennya ke dalam larutan. Oleh itu, ia kurang mampu berbanding dengan asid yang kuat dalam mengeluarkan proton. Asid lemah mempunyai PKA yang lebih tinggi daripada asid kuat.
Asid etanoik adalah contoh yang baik dari asid lemah. Ia menunjukkan tindak balas dengan h2O Untuk menghasilkan H3O+ (Ion hidroksonium) dan CH3COOH (ion etanoat), tetapi tindak balas terbalik menunjukkan lebih banyak kejayaan daripada yang ke hadapan. Molekul bertindak balas dengan mudah untuk memperbaiki asid dan h2O.

Pada satu -satu masa, hanya kira -kira satu peratus daripada ch3Molekul asid COOH menunjukkan penukaran ke dalam ion. Apa sahaja yang tersisa adalah molekul asid asetik yang mudah (sistematik dipanggil asid etanoik).
Perbezaan antara asid kuat dan asid lemah
-
Definisi
Asid kuat
Asid kuat adalah asid yang mengionkan sepenuhnya dalam larutan akueus. Asid yang kuat akan sentiasa longgar proton (A H+) apabila dibubarkan dalam h2O. Dalam erti kata lain, asid yang kuat selalu berada di jari kaki dan cukup efisien dalam melepaskan proton.
Asid lemah
Asid lemah adalah satu yang mengionkan sebahagiannya dalam larutan. Ia hanya mengeluarkan sedikit atom hidrogennya ke penyelesaian. Oleh itu ia kurang mampu daripada asid yang kuat.
-
Kekonduksian elektrik
Asid kuat
Asid kuat akan selalu menunjukkan kekonduksian yang kuat. Asid kuat biasanya melewati lebih banyak arus berbanding dengan asid lemah untuk voltan dan kepekatan yang sama.
Asid lemah
Asid lemah mempunyai kekonduksian yang rendah. Mereka adalah konduktor yang lemah dan menunjukkan nilai yang rendah untuk lulus semasa
-
Kadar tindak balas
Asid kuat
Kadar tindak balas lebih cepat dalam asid kuat
Asid lemah
Kadar tindak balas lebih perlahan dalam asid lemah
-
Contoh
Asid kuat
Asid hidroklorik (HCl), asid nitrik (HNO3), Asid perchloric (HCLO4), Asid sulfurik (h2Jadi4), Asid hidroiodik (HI), asid hidrobromik (HBR), asid klorik (HCLO3).
Asid lemah
Asid sulfur (h2Jadi3), Asid asetik (CH3COOH), asid fosforik (H3PO4), Asid benzoik (c6H5COOH), asid hidrofluorik (HF), asid formik (HCOOH), asid nitrous (HNO2).
-
Ph
Asid kuat
Dalam asid yang kuat, pH lebih rendah daripada, secara amnya 3. Asid kuat mempunyai kepekatan ion H+ yang sangat tinggi (asid yang mempunyai pH 3 mempunyai 0.001 tahi liter seliter ion hidrogen).
Asid lemah
Asid lemah mempunyai pH antara 3-7.
-
Nilai PKA
Asid kuat
Dalam asid yang kuat, nilai PKA agak rendah.
Asid lemah
Dalam asid lemah, nilai PKA agak tinggi.
-
Penyisihan
Asid kuat
HCl (G)+H2O (L) ≈ H3O+(aq)+cl-(aq)
Asid lemah
Ch3COOH (L)+H2O (L) ≈ H3O+(aq)+ch3COO-(aq)
Ringkasan asid kuat vs. Asid lemah
Titik perbezaan antara asid yang kuat dan lemah telah diringkaskan di bawah: carta perbandingan