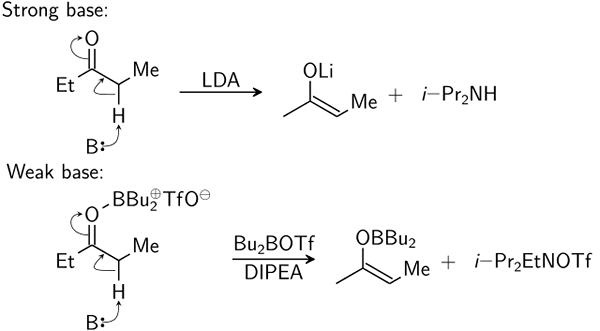
Perbezaan antara asas lemah dan asas yang kuat
- 810
- 149
- Johnnie Purdy
Beberapa definisi asas digunakan dalam kimia kontemporari:
- Pangkalan Arrhenius - Bahan yang meningkatkan kepekatan anion hidroksida apabila dibubarkan di dalam air;
- Pangkalan Brønsted -Lowry - bahan yang mengambil proton apabila bertindak balas dengan asid;
- Pangkalan Lewis - Bahan yang menghasilkan sepasang elektron bahan lain, ketika bertindak balas dengan asid.
Yang paling banyak digunakan ialah definisi Brøndsted- Lowry.
Pangkalan dalam erti kata luas termasuk tiga kumpulan bahan:
- Hidroksida logam larut air: NaOH, CA (OH)2, dan lain-lain.;
- Oksida tidak larut air atau hidroksida yang boleh bertindak balas dengan asid: Feo, al (OH)3, dan lain-lain.;
- Sebatian lain yang, apabila dibubarkan di dalam air, berinteraksi dengannya dan melepaskan ion hidroksida: NH3, Ch3NH2, dan lain-lain.
Beberapa sifat umum pangkalan adalah:
- Sabun atau sentuhan berlendir;
- Rasa pahit;
- Kekonduksian elektrik;
- Tindak balas ganas dengan bahan reducible atau berasid; kaustik pada bahan organik;
- Putar kertas merah litmus merah.
Apa itu asas yang lemah?
Pangkalan lemah hanya sebahagiannya berpecah untuk memberi ion dalam penyelesaian.
Apabila asas mengionkan, ia meninggalkan oh- ion di belakang dengan mengambil ion hidrogen dari air. Penyelesaian pangkalan yang lemah mempunyai h yang lebih tinggi+ kepekatan daripada pangkalan yang kuat.
Asas penyelesaian berair ditentukan oleh pH.
ph = -log10 [H+]
PH pangkalan lebih tinggi daripada 7.3. Lemah dianggap sebagai pangkalan dengan pH di bawah 10.
Oleh kerana pangkalan adalah penerima proton, pangkalan menerima oh- ion dari air. Pangkalan lemah kurang protonasi sepenuhnya daripada pangkalan yang lebih kuat dan, oleh itu mempunyai h yang lebih tinggi+ kepekatan dalam penyelesaian. Lebih tinggi h+ Kepekatan menghasilkan pH yang lebih rendah.
Dalam larutan air, asas ada dalam keseimbangan kimia. Kedudukan keseimbangan berbeza -beza bergantung kepada kekuatan asas. Semakin lemah pangkalan, lebih jauh ke kiri akan mengalihkan keseimbangan.
Kedudukan keseimbangan diukur oleh pemalar keseimbangan (kb). Semakin banyak keseimbangan terletak di sebelah kiri, semakin rendah nilai untuk pemalar. Oleh itu, pangkalan yang lebih lemah mempunyai pemalar keseimbangan yang lebih rendah.
Pangkalan lemah adalah elektrolit yang lemah.
Keupayaan penyelesaian untuk menjalankan elektrik bergantung kepada kepekatan ion. Penyelesaian asas yang lemah mempunyai ion yang lebih sedikit daripada penyelesaian yang kuat, dan oleh itu ia mempunyai kekonduksian elektrik yang lebih rendah.
Contoh pangkalan yang lemah adalah:
- Alanine (c3H5O2NH2);
- Ethylamine (c2H5NH2);
- Dimethylamine ((CH3)2NH);
- Methylamine (Ch3NH2);
- Glycine (c2H3O2NH2);
- Trimethylamine ((CH3)3N);
- Hydrazine (n2H4).

Apa itu asas yang kuat?
Pangkalan yang kuat sepenuhnya memisahkan ion dalam penyelesaian. Mereka mempunyai pH antara 10 dan 14.
Pangkalan yang kuat adalah kaustik untuk tisu hidup dan boleh menyebabkan kesan yang serius. Contoh umum asas yang kuat adalah hidroksida logam alkali dan alkali bumi.
Pangkalan yang sangat kuat boleh merosakkan kumpulan C-H berasid lemah walaupun dalam ketiadaan air.
Pangkalan yang kuat mempunyai pemalar keseimbangan yang lebih tinggi, berbanding dengan yang lebih lemah.
Pangkalan yang kuat sangat reaktif. Mereka adalah elektrolit yang baik.
Keupayaan penyelesaian untuk menjalankan elektrik bergantung kepada kepekatan ion. Pangkalan yang kuat mempunyai lebih banyak ion dalam penyelesaian daripada yang lemah, jadi ia mempunyai kekonduksian elektrik yang lebih tinggi.
Contoh asas yang kuat adalah:
- Strontium Hydroxide (SR (OH)2);
- Barium Hydroxide (BA (OH)2);
- Kalsium hidroksida (CA (OH)2);
- Natrium hidroksida (NaOH);
- Cesium hidroksida (CSOH);
- Potassium Hydroxide (KOH).
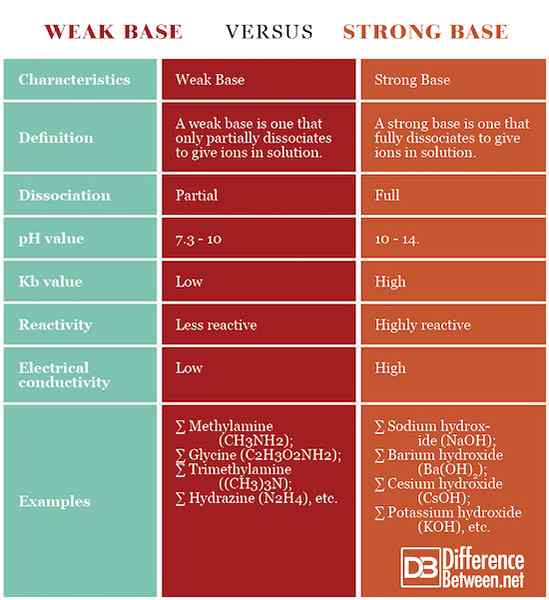
Perbezaan antara asas lemah dan asas yang kuat
-
Definisi
Pangkalan lemah: Pangkalan yang lemah adalah salah satu yang hanya sebahagiannya memisahkan ion dalam penyelesaian.
Pangkalan yang kuat: Pangkalan yang kuat adalah salah satu yang memisahkan sepenuhnya untuk memberi ion dalam penyelesaian.
-
Penyisihan
Pangkalan lemah: Pangkalan lemah hanya sebahagiannya memisahkan penyelesaian.
Pangkalan yang kuat: Pangkalan yang kuat sepenuhnya memisahkan penyelesaian.
-
nilai pH
Pangkalan lemah: Pangkalan lemah mempunyai pH 7.3 - 10.
Pangkalan yang kuat: Pangkalan yang kuat mempunyai pH 10 - 14.
-
Nilai kb
Pangkalan lemah: Pangkalan lemah mempunyai pemalar keseimbangan yang lebih rendah, berbanding dengan yang kuat.
Pangkalan yang kuat: Pangkalan yang kuat mempunyai pemalar keseimbangan yang lebih tinggi, berbanding dengan yang lemah.
-
Reaktiviti
Pangkalan lemah: Pangkalan lemah kurang reaktif daripada yang kuat.
Pangkalan yang kuat: Pangkalan yang kuat sangat reaktif.
-
Kekonduksian elektrik
Pangkalan lemah: Penyelesaian asas yang lemah mempunyai kekonduksian elektrik yang lebih rendah daripada asas yang kuat.
Pangkalan yang kuat: Penyelesaian asas yang kuat mempunyai kekonduksian elektrik yang lebih tinggi daripada asas yang lemah.
-
Contoh
Pangkalan lemah: Contoh pangkalan yang lemah adalah methylamine (CH3NH2), glisin (c2H3O2NH2), trimethylamine ((ch3)3N), hydrazine (n2H4), dan lain-lain.
Pangkalan yang kuat: Contoh asas yang kuat ialah natrium hidroksida (NaOH), cesium hidroksida (CSOH), kalium hidroksida (KOH), barium hidroksida (BA (OH)2), dan lain-lain.
Lemah vs. Pangkalan Kuat: Carta Perbandingan
Ringkasan lemah vs. Asas yang kuat
- Menurut definisi Brønsted-Lowry, asas adalah bahan yang mengambil proton apabila bertindak balas dengan asid.
- Pangkalan mempunyai sabun atau sentuhan berlendir dan rasa pahit. Mereka bertindak balas dengan ganas dengan bahan yang boleh diturunkan atau berasid dan kaustik pada bahan organik.
- Pangkalan yang lemah adalah salah satu yang hanya sebahagiannya memisahkan ion dalam penyelesaian.
- Pangkalan yang kuat adalah salah satu yang memisahkan sepenuhnya untuk memberi ion dalam penyelesaian.
- Pangkalan lemah hanya sebahagiannya memisahkan penyelesaian, sementara pangkalan yang kuat memisahkan sepenuhnya dalam penyelesaian.
- Pangkalan lemah mempunyai pH 7.3 - 10, yang kuat mempunyai pH 10 - 14.
- Pangkalan yang lemah mempunyai pemalar keseimbangan yang lebih rendah, sementara pangkalan yang kuat mempunyai pemalar keseimbangan yang lebih tinggi.
- Pangkalan yang kuat sangat reaktif, sementara pangkalan yang lemah kurang reaktif.
- Penyelesaian asas yang lemah mempunyai kekonduksian elektrik yang lebih rendah daripada asas yang kuat.
- Contoh pangkalan yang lemah adalah methylamine (CH3NH2), glisin (c2H3O2NH2), trimethylamine ((ch3)3N), hydrazine (n2H4), dan lain-lain. Contoh pangkalan yang kuat adalah natrium hidroksida (NaOH), barium hidroksida (BA (OH)2), cesium hidroksida (CSOH), kalium hidroksida (KOH), dll.

