Homogen vs. Campuran heterogen

- 3882
- 1210
- Johnnie Purdy
Campuran berbeza dari bahan tulen seperti unsur dan sebatian kerana campuran mengandungi bahan yang berbeza yang digabungkan secara fizikal tetapi tidak secara kimia. Komponen individu dalam campuran mengekalkan identiti mereka.
Campuran adalah dua jenis: homogen dan heterogen. Campuran homogen mempunyai komposisi dan penampilan seragam. Bahan individu yang membentuk campuran homogen tidak dapat dibezakan secara visual. Sebaliknya, campuran heterogen terdiri daripada dua atau lebih bahan yang dapat diperhatikan dengan jelas, dan bahkan dipisahkan dengan mudah.
Carta Perbandingan
Perbezaan - Persamaan -| Heterogen | Homogen | |
|---|---|---|
| Seragam | Tidak | Ya |
| Anda dapat melihat bahagiannya | Ya | Tidak |
| Boleh dipisahkan secara fizikal | Ya | Tidak |
| Contoh | Salad, campuran jejak | Minyak zaitun, keluli, garam di dalam air |
| Terikat secara kimia | Tidak | Tidak |
Ciri -ciri fizikal
Semua campuran terdiri daripada dua atau lebih bahan tulen (elemen atau sebatian). Perbezaan antara campuran dan sebatian adalah bagaimana unsur -unsur atau bahan bergabung untuk membentuknya. Sebatian adalah bahan murni kerana hanya mengandungi satu jenis molekul. Molekul diperbuat daripada atom yang terikat bersama. Tetapi dalam campuran, unsur -unsur dan sebatian kedua -duanya dijumpai secara fizikal tetapi tidak secara kimia-tiada ikatan atom antara bahan tulen yang membentuk campuran.
Tetapi tanpa mengira ikatan atom, campuran boleh menjadi agak kohesif. Biasanya dipanggil penyelesaian, Campuran homogen adalah di mana bahan -bahan itu bercampur dengan baik sehingga mereka tidak dapat dilihat secara individu dalam bentuk yang berbeza dan berbeza. Komposisi mereka seragam i.e., Sama sepanjang campuran. Keseragaman ini adalah kerana konstituen campuran homogen berlaku dalam perkadaran yang sama di setiap bahagian campuran.
Sebaliknya campuran heterogen adalah satu di mana bahan konstituen tidak diedarkan secara seragam. Mereka sering boleh diberitahu secara visual dan juga dipisahkan dengan mudah, walaupun banyak kaedah wujud untuk memisahkan penyelesaian homogen juga.
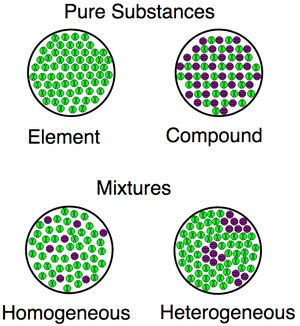 Visualisasi untuk perbezaan antara bahan (sebatian, elemen) dan campuran (kedua -dua homogen dan heterogen).
Visualisasi untuk perbezaan antara bahan (sebatian, elemen) dan campuran (kedua -dua homogen dan heterogen). Contoh campuran homogen dan heterogen
Contoh campuran heterogen akan menjadi kiub ais (sebelum mereka mencairkan) dalam soda, bijirin dalam susu, pelbagai topping pada pizza, topping dalam yogurt beku, kotak kacang pelbagai jenis. Malah campuran minyak dan air adalah heterogen kerana ketumpatan air dan minyak berbeza, yang menghalang pengedaran seragam dalam campuran.
Contoh campuran homogen adalah milkshake, jus sayuran yang dicampur, gula yang dibubarkan dalam kopi, alkohol di dalam air, dan aloi seperti keluli. Malah udara yang berada di atmosfera kita adalah campuran homogen pelbagai gas dan depending di bandar yang anda tinggal di peniaga. Banyak bahan, seperti garam dan gula, larut dalam air untuk membentuk campuran homogen.
Jenis campuran
Terdapat tiga keluarga campuran: penyelesaian, penggantungan dan koloid. Penyelesaian adalah homogen manakala penggantungan dan koloid adalah heterogen.
Penyelesaian
Penyelesaian adalah campuran homogen yang mengandungi larutan yang dibubarkan dalam pelarut, e.g. garam dibubarkan di dalam air. Apabila pelarut adalah air, ia dipanggil penyelesaian berair. Nisbah jisim larut ke pelarut dipanggil kepekatan penyelesaiannya.
Penyelesaian boleh menjadi cecair, gas atau bahkan pepejal. Bukan itu sahaja, komponen penyelesaian individu boleh menjadi keadaan perkara yang berbeza. Solute menganggap fasa (pepejal, cecair atau gas) pelarut apabila pelarut adalah pecahan yang lebih besar dari campuran.
- Penyelesaian Gaseous: Apabila pelarut adalah gas, hanya mungkin untuk membubarkan larutan gas di dalamnya. Contoh yang paling biasa dari penyelesaian gas adalah udara di atmosfera kita, iaitu nitrogen (pelarut) dan mempunyai larutan seperti oksigen dan gas lain.
- Penyelesaian Cecair: Pelarut cecair mampu membubarkan sebarang jenis larutan.
- Gas dalam Cecair: Contohnya termasuk oksigen di dalam air, atau karbon dioksida di dalam air.
- Cecair dalam cecair: Contoh termasuk minuman beralkohol; mereka adalah penyelesaian etanol di dalam air.
- Pepejal dalam cecair: Penyelesaian gula atau garam di dalam air adalah contoh campuran tersebut. Banyak pepejal dalam campuran cecair tidak homogen sehingga mereka bukan penyelesaian. Mereka boleh menjadi koloid atau penggantungan.
- Penyelesaian Pepejal: Pelarut pepejal juga boleh membubarkan larutan mana -mana keadaan.
- Gas dalam Pepejal: Contohnya adalah hidrogen yang dibubarkan di Palladium
- Cecair dalam Pepejal: Contoh ini termasuk merkuri dalam emas, membentuk amalgam, dan air (kelembapan) dalam garam
- Pepejal dalam pepejal: aloi seperti keluli, tembaga atau gangsa adalah contoh campuran tersebut.
Penggantungan
Penggantungan adalah campuran heterogen yang mengandungi zarah pepejal yang cukup besar untuk pemendapan. Zarah pepejal tidak larut dalam pelarut tetapi digantung dan bebas terapung. Mereka lebih besar daripada 1 mikrometer dan biasanya cukup besar untuk dilihat dengan mata kasar. Contohnya adalah pasir di dalam air. Ciri utama penggantungan adalah bahawa zarah -zarah yang digantung menetap dari masa ke masa jika tidak terganggu.
Colloid
Colloids heterogen seperti penggantungan tetapi secara visual kelihatan homogen kerana zarah-zarah dalam campuran sangat kecil-1 nanometer hingga 1 mikrometer. Perbezaan antara koloid dan penggantungan adalah bahawa zarah -zarah dalam koloid lebih kecil dan zarah -zarah tidak akan diselesaikan dari masa ke masa.
| Penyelesaian | Colloid | Penggantungan | |
|---|---|---|---|
| Homogeniti | Homogen | Heterogen pada tahap mikroskopik tetapi visual homogen | Heterogen |
| Saiz Zarah | < 1 nanometer (nm) | 1 nm - 1 mikrometer (μm) | > 1 μm |
| Stabil secara fizikal | Ya | Ya | Memerlukan ejen penstabilan |
| Mempamerkan kesan Tyndall | Tidak | Ya | Ya |
| Memisahkan oleh centrifuge | Tidak | Ya | Ya |
| Memisahkan oleh penyahkodan | Tidak | Tidak | Ya |
Teknis
Setakat tertentu, anda boleh mengatakan (jika anda sedang pedantic) bahawa persoalan sama ada campuran adalah homogen atau heterogen bergantung pada skala di mana campuran sedang dicontohi.
Sekiranya skala pensampelan baik (kecil), ia boleh menjadi sekecil seperti molekul tunggal. Dalam hal ini, sebarang sampel akan menjadi heterogen kerana ia dapat ditandakan dengan jelas pada skala itu. Begitu juga, jika sampel adalah campuran keseluruhan, anda boleh menganggapnya cukup homogen.
Oleh itu, untuk tetap praktikal, kita menggunakan peraturan ini untuk menentukan sama ada campuran homogen: jika harta kepentingan campuran adalah sama tanpa mengira sampel yang diambil untuk peperiksaan yang digunakan, campuran adalah homogen.

