Bon kovalen vs. Ikatan ionik
- 684
- 35
- Timothy Ankunding
Terdapat dua jenis ikatan atom - ikatan ionik dan ikatan kovalen. Mereka berbeza dalam struktur dan sifat mereka. Ikatan kovalen terdiri daripada pasangan elektron yang dikongsi oleh dua atom, dan mengikat atom dalam orientasi tetap. Tenaga yang agak tinggi diperlukan untuk memecahkannya (50 - 200 kcal/mol). Sama ada dua atom boleh membentuk ikatan kovalen bergantung kepada elektronegativiti mereka i.e. Kekuatan atom dalam molekul untuk menarik elektron dengan sendirinya. Sekiranya dua atom berbeza jauh dalam elektronegativiti mereka - seperti natrium dan klorida - maka salah satu atom akan kehilangan elektronnya ke atom lain. Ini mengakibatkan ion (kation) yang dicas positif dan ion caj negatif (anion). Ikatan antara kedua -dua ion ini dipanggil ikatan ionik.
Carta Perbandingan
| Ikatan kovalen | Ikatan ionik | |
|---|---|---|
| Apa itu? | Ikatan kovalen adalah bentuk ikatan kimia antara dua atom bukan logam yang dicirikan oleh perkongsian pasangan elektron antara atom dan ikatan kovalen lain. | Ikatan ionik, juga dikenali sebagai ikatan elektrovalen adalah sejenis ikatan yang terbentuk dari tarikan elektrostatik antara ion yang bertentangan dengan ion kimia. Jenis ikatan ini berlaku terutamanya di antara atom logam dan bukan logam. |
| Pembentukan | Ikatan kovalen dibentuk di antara dua logam yang mempunyai elektronegativiti yang serupa. Atom tidak cukup "kuat" untuk menarik elektron dari yang lain. Untuk penstabilan, mereka berkongsi elektron mereka dari orbit molekul luar dengan orang lain. | Ikatan ionik terbentuk di antara logam dan bukan logam. Bukan logam (-ve ion) adalah "lebih kuat" daripada logam (+ve ion) dan boleh mendapatkan elektron dengan mudah dari logam. Kedua -dua ion bertentangan ini menarik satu sama lain dan membentuk ikatan ionik. |
| Berlaku antara | Dua bukan logam | Satu logam dan satu bukan logam |
| Elektron | Elektron dikongsi dalam ikatan kovalen. | Dalam ikatan ionik, elektron dipindahkan dari satu atom ke yang lain, mengakibatkan dua ion yang dikenakan - satu yang dikenakan secara positif, dan satu negatif dikenakan. Kedua -dua ion ini tertarik antara satu sama lain dan membentuk ikatan ionik. |
| Contoh | Metana (CH4), asid klorik hidro (HCL) | Natrium klorida (NaCl), asid sulfurik (H2SO4) |
| Takat lebur | Rendah | Tinggi |
| Larut dalam air? | Berbeza | Ya |
| Polariti | Rendah | Tinggi |
| Bentuk | Bentuk pasti | Tiada bentuk yang pasti |
| Takat didih | Rendah | Tinggi |
| Nyatakan pada suhu bilik | Cecair atau gas | Pepejal |
| Konsistensi | Lembut | Rapuh |
Mengenai ikatan kovalen dan ionik
Ikatan kovalen dibentuk apabila dua atom dapat berkongsi elektron manakala ikatan ionik terbentuk apabila "perkongsian" begitu tidak sama rata sehingga elektron dari atom A hilang sepenuhnya kepada atom b, mengakibatkan sepasang ion.
Setiap atom terdiri daripada proton, neutron dan elektron. Di tengah atom, neutron dan proton tinggal bersama. Tetapi elektron berputar di orbit di sekitar pusat. Setiap orbit molekul ini boleh mempunyai sejumlah elektron untuk membentuk atom yang stabil. Tetapi selain gas lengai, konfigurasi ini tidak hadir dengan kebanyakan atom. Jadi untuk menstabilkan atom, setiap atom berkongsi separuh daripada elektronnya.
Ikatan kovalen adalah bentuk ikatan kimia antara dua atom bukan logam yang dicirikan oleh perkongsian pasangan elektron antara atom dan ikatan kovalen lain. Ikatan ionik, juga dikenali sebagai ikatan elektrovalen, adalah sejenis ikatan yang terbentuk dari tarikan elektrostatik antara ion yang bertentangan dengan ion kimia. Ikatan seperti ini berlaku terutamanya di antara atom logam dan bukan logam.
Pembentukan dan contoh
Bon kovalen dibentuk sebagai hasil perkongsian satu atau lebih pasang elektron ikatan. Negativiti elektro (keupayaan menarik elektron) dari dua atom terikat sama ada atau perbezaannya tidak lebih besar daripada 1.7. Selagi perbezaan elektro-negatif tidak melebihi 1.7, atom hanya boleh berkongsi elektron ikatan.
 Model ikatan kovalen dua dan tunggal karbon dalam cincin benzena.
Model ikatan kovalen dua dan tunggal karbon dalam cincin benzena. Sebagai contoh, marilah kita mempertimbangkan molekul metana i.e.Ch4. Karbon mempunyai 6 elektron dan konfigurasi elektroniknya ialah 1S22S22P2, i.e. ia mempunyai 4 elektron di orbit luarnya. Menurut peraturan oktat (ia menyatakan bahawa atom cenderung mendapat, kehilangan, atau berkongsi elektron supaya setiap atom mempunyai tahap tenaga paling luar yang biasanya 8 elektron.), berada dalam keadaan stabil, ia memerlukan 4 lagi elektron. Jadi ia membentuk ikatan kovalen dengan hidrogen (1S1), dan dengan berkongsi elektron dengan hidrogen ia membentuk metana atau ch4.
Sekiranya perbezaan elektro-negatif lebih besar daripada 1.7 Kemudian atom elektronegatif yang lebih tinggi mempunyai keupayaan menarik elektron yang cukup besar untuk memaksa pemindahan elektron dari atom elektronegatif yang lebih rendah. Ini menyebabkan pembentukan ikatan ionik.
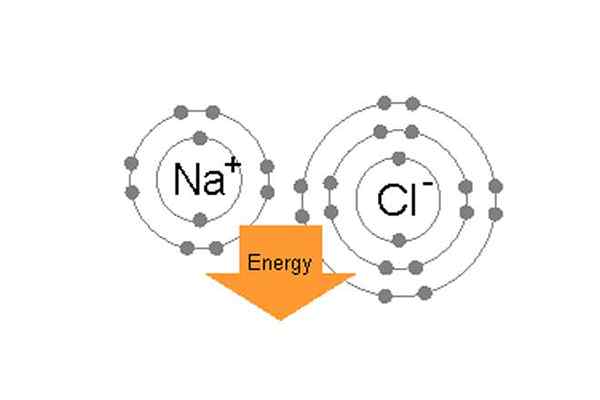
 Ikatan natrium dan klorin secara ionik untuk membentuk natrium klorida.
Ikatan natrium dan klorin secara ionik untuk membentuk natrium klorida. Sebagai contoh, dalam garam meja biasa (NaCl) atom individu adalah natrium dan klorin. Klorin mempunyai tujuh elektron valensi di orbit luarnya tetapi berada dalam keadaan stabil, ia memerlukan lapan elektron di orbit luar. Sebaliknya, natrium mempunyai satu elektron valensi dan ia juga memerlukan lapan elektron. Oleh kerana klorin mempunyai elektro-negatif yang tinggi, 3.16 berbanding dengan natrium 0.9, (jadi perbezaan antara elektro-negatif mereka lebih dari 1.7) Klorin dengan mudah dapat menarik satu elektron valensi natrium. Dengan cara ini mereka membentuk ikatan ionik, dan berkongsi elektron masing -masing dan kedua -duanya akan mempunyai 8 elektron di dalam kerang luar mereka.
Ciri -ciri Bon
Ikatan kovalen mempunyai bentuk yang pasti dan boleh diramal dan mempunyai titik lebur dan mendidih yang rendah. Mereka dapat dengan mudah dipecah menjadi struktur utamanya kerana atom dekat untuk berkongsi elektron. Ini kebanyakannya gas dan sedikit caj negatif atau positif di hujung bertentangan ikatan kovalen memberi mereka polariti molekul.
Ikatan ionik biasanya membentuk sebatian kristal dan mempunyai titik lebur yang lebih tinggi dan titik mendidih berbanding dengan sebatian kovalen. Ini menjalankan elektrik dalam keadaan cair atau penyelesaian dan mereka adalah ikatan kutub. Kebanyakannya larut dalam air tetapi tidak larut dalam pelarut bukan polar. Mereka memerlukan lebih banyak tenaga daripada ikatan kovalen untuk memecahkan ikatan di antara mereka.
Sebab perbezaan dalam pencairan dan titik mendidih untuk ikatan ionik dan kovalen ialah jumlah tenaga yang diperlukan untuk mengganggu daya intermolecular antara molekul yang dibentuk melalui ikatan kovalen jauh lebih rendah daripada tenaga yang diperlukan untuk memecahkan ikatan ionik dalam kompaun ionik kristal.

