Perbezaan antara tempoh dan kumpulan
- 1477
- 156
- Mrs. Ted Marks
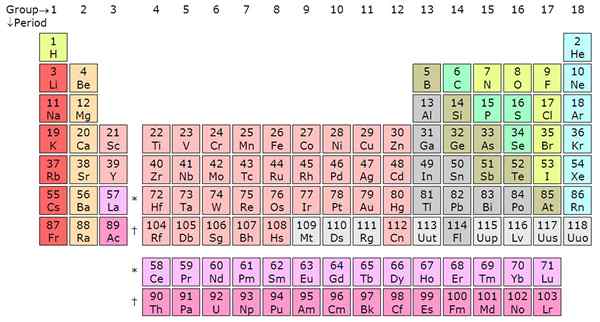
Tempoh dan kumpulan adalah dua klasifikasi penting yang digunakan oleh ahli kimia kuno untuk mengatur jadual berkala ikonik ke dalam lajur dan baris. Tempoh adalah baris mendatar manakala kumpulan, yang juga dikenali sebagai keluarga, adalah lajur menegak. Unsur -unsur diatur ke dalam kumpulan dan tempoh berdasarkan ciri -ciri tertentu seperti sifat kimia/fizikal untuk kumpulan dan konfigurasi elektron untuk tempoh. Artikel ini membentangkan perbezaan selanjutnya antara tempoh dan kumpulan.

Apa tempoh?
Mengira dari kiri ke kanan pada jadual berkala, ia adalah tempoh. Biasanya terdapat 7 tempoh dalam jadual berkala dan setiap tempoh menandakan cangkang tenaga baru. Dari hidrogen ke francium dalam tempoh 7, unsur -unsur meningkat dalam orbital atom. Ini bermakna elektron elemen akan diwakili pada bilangan tahap tenaga tertentu selaras dengan label berkala.
Sebagai contoh, lithium (li) mempunyai dua kulit tenaga kerana ia berada dalam tempoh 2 manakala kalium (k) mempunyai empat cengkerang tenaga kerana ia berada dalam tempoh 4. Trend ini berlaku untuk semua elemen lain. Dalam satu tempoh, unsur -unsur berkongsi elektron shell luar (valensi). Contohnya, hidrogen dan helium berada dalam kumpulan yang sama dan mempunyai satu elektron di kulit luar. Perhatikan bahawa tempoh pertama hanya mempunyai dua elemen. Tempoh kedua dan ketiga mempunyai 8 elemen masing -masing.
Tempoh 4 dan 5 masing -masing mempunyai 18 elemen. Jadual berkala mempunyai, secara keseluruhan, 18 kumpulan seperti sistem penamaan IUPAC. Tempoh 6 dan 7 adalah pengecualian kerana ia mengandungi 32 elemen secara keseluruhan. Ini menjelaskan mengapa jadual berkala dipendekkan dengan mengeluarkan sebahagian daripada tempoh 6 dan 7 dan memaparkan tepat di bawah jadual berkala. Berkala akan menjadi besar jika actinides dan lanthanides tidak dikeluarkan. Unsur-unsur yang dipisahkan ini adalah logam peralihan dalaman dan mereka mengisi blok F di orbital atom. Lanthanides termasuk unsur -unsur dari 58 hingga 71 manakala actinides termasuk unsur -unsur dari 89 hingga ke 103.
Ciri -ciri lain bahawa unsur -unsur dalam tempoh saham adalah peningkatan tenaga pengionan. Atom dalam tempoh peningkatan dalam bilangan atom kerana lebih banyak proton semakin ditambah. Ini meningkatkan daya tarikan dalam nukleus dan ia akan menjadi agak sukar untuk mengeluarkan elektron. Caj nuklear meningkat di seluruh jadual berkala. Juga, elektronegativiti meningkat apabila anda bergerak dari kiri ke kanan sepanjang tempoh. Affinity elektron juga meningkat apabila lebih banyak elektron ditambah sehingga meningkatkan daya tarikan yang kuat dengan nukleus.
Apa itu kumpulan?
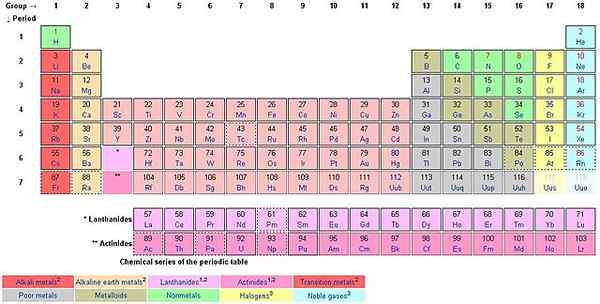
Semasa anda menghitung dari atas ke bawah di sepanjang lajur, anda menghitung kumpulan. Gaya Penamaan Eropah ꟷ kini diterima pakai sebagai gaya penamaan IUPAC, digunakan untuk menamakan kumpulan dari 1 hingga 18. Gaya AS menggunakan AS dan BS.
Setiap 18 kumpulan menanggung nama. Sebagai contoh, kumpulan pertama dikenali sebagai keluarga litium (logam alkali), kumpulan 2 keluarga berilium (logam alkali bumi, kumpulan 3 keluarga scandium, kumpulan 4 keluarga titanium, kumpulan 5 keluarga vanadium, kumpulan 6 keluarga kromium , Kumpulan 7 Keluarga Mangan, Kumpulan 8 Keluarga Besi, Kumpulan 9 Keluarga Cobalt, Kumpulan 10 Keluarga Nikel, Kumpulan 11 Keluarga Tembaga (Koin Logam), Kumpulan 12 Keluarga Zink (Logam yang Tidak Melangkah), Kumpulan 13 Keluarga Boron (Icoasagens), Kumpulan 14 Keluarga Karbon (Crystallogens, Tetrels), Kumpulan 15 Keluarga Nitrogen (Pentels), Kumpulan 16 Keluarga oksigen (chalcogens), kumpulan 17 keluarga fluorin (halogen), dan kumpulan 18 helium atau keluarga neon ( gas mulia).
Unsur -unsur dalam kumpulan berkongsi sifat kimia atau fizikal. Kumpulan 18, sebagai contoh, dirujuk sebagai gas mulia. Mereka tidak reaktif dengan unsur-unsur lain. Peraturan oktet 8 elektron di kulit luar terpakai dengan sempurna untuk gas mulia. Semua elemen lain berusaha untuk mencapai peraturan oktet. Hidrogen tidak mengikuti peraturan oktet dan begitu juga helium walaupun ia stabil dan sebahagian daripada gas mulia.
Jadual Tempoh mempunyai campuran logam, bukan logam dan metalloid (semimetal). Terdapat unsur -unsur pengelompokan tertentu mengikut sifat yang sama dan ini termasuk logam alkali, logam bumi alkali, logam peralihan (lanthanides, logam nadir bumi dan actinides), nonmetal, metalloid, gas mulia, halogen dan logam asas.
Terdapat juga trend peningkatan sifat semasa anda turun atau naik kumpulan. Semasa anda naik, Electron Affinity 9Electron Loving) harta meningkat. Apabila anda turun kumpulan, kerang tenaga meningkat dan dengan itu daya tarikan dalam nukleus berkurangan, maka pertalian elektron berkurangan ketika anda turun. Elektronegatif juga berkurangan apabila anda turun kumpulan kerana peningkatan tahap tenaga di bawah kumpulan. Elektron di kulit luar cenderung jauh dari nukleus dan oleh itu kolam berkurang.
Perbezaan utama antara tempoh dan kumpulan
Lokasi di meja berkala
Tempoh adalah baris mendatar manakala kumpulan adalah lajur menegak pada jadual berkala. Terdapat 7 tempoh dan 18 kumpulan. Tempoh 6 dan 7 mempunyai 32 elemen kerana penambahan actinides dan lanthanides.
Menentukan ciri -ciri
Unsur dalam kumpulan berkongsi sifat kimia atau fizikal yang serupa. Mereka mempunyai bilangan elektron valensi yang sama. Sebaliknya, unsur -unsur dalam tempoh yang sama berkongsi konfigurasi elektron yang sama.
Elektronegativiti
Elektronegatif berkurangan apabila anda turun kumpulan dan meningkat apabila anda naik disebabkan peningkatan tarikan dalam nukleus akibat daripada tahap tenaga yang lebih sedikit. Elektronegativiti meningkat apabila anda pergi dari kiri ke kanan sepanjang tempoh dengan penambahan lebih banyak proton apabila bilangan atom meningkat.
Tempoh vs. Kumpulan: Borang Tabular

Ringkasan Tempoh vs. Kumpulan
- Jadual berkala disusun dalam tempoh dan kumpulan
- Kumpulan adalah lajur menegak manakala tempoh adalah baris mendatar
- Unsur -unsur dalam kumpulan berkongsi sifat kimia atau fizikal manakala unsur -unsur dalam tempoh mempunyai konfigurasi elektron yang sama
- Terdapat 7 tempoh dan 18 kumpulan di Jadual Berkala
- Elektronegativiti meningkat dari kiri ke kanan dalam tempoh dan dari bawah ke atas dalam kumpulan

